вибір читачів
Популярні статті
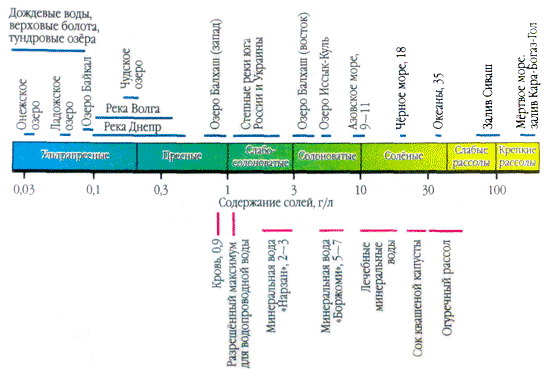
Якщо крапельку природної води нанести на скло і почекати, поки вона випарується, то на місці краплини буде видно білі розводи - це кристалізуються розчинні у воді солі. Зміст солей в природних водах різниться в тисячі разів. Наприклад, в літрі дощової води містяться одиниці, максимум десятки міліграмів солей. А в літрі води із затоки Кара-Богаз-Гол (Каспійське море) - 300 г, майже третина від маси розчину.
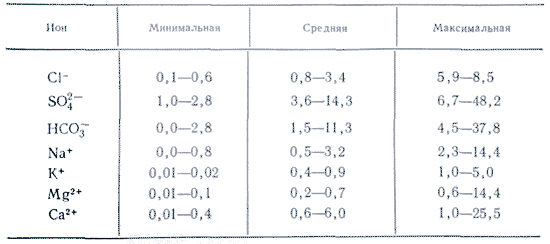
У водних розчинах переважна більшість солей існує у вигляді іонів. У природних водах переважають три аниона ( гідрокарбонат HCO 3 -, хлорид Cl - і сульфат SO 4 2-) І чотири катіона ( кальцій Ca 2+, магній Mg 2+, натрій Na + і калій K +) - їх називають головними іонами. Хлорид-іони надають воді солоний смак, сульфат-іони, іони кальцію і магнію - гіркий, гідрокарбонат-іони несмачні. Вони складають в прісних водах понад 90-95%, а в високомінералізованих - понад 99% всіх розчинених речовин. Зазвичай нижньою межею концентрації для головних іонів вважають 1 мг / л, тому в ряді випадків, наприклад для морських і деяких підземних вод, до головних компонентів можна віднести також Br -, B 3+, Sr 3+ і ін. Віднесення іонів K + до числу головних є спірним. У підземних і поверхневих водах ці іони, як правило, займають другорядне становище. Тільки в атмосферних опадах іони K + можуть грати головну роль.
Однак іонна форма головних компонентів властива повною мірою лише маломінералізованих вод. При збільшенні концентрації між іонами посилюється взаємодія, спрямоване на асоціацію, тобто процес, зворотний дисоціації. При цьому утворюються асоційовані іонні пари, наприклад MgHCO 3 +, CaHCO 3 +.
Під впливом кліматичних та інших умов хімічний склад природних вод змінюється і набуває характерні риси, іноді специфічні для різних видів природних вод (атмосферні опади, річки, озера, підземні води).
Атмосферні опади з усіх природних вод найменш мінералізовані, але за хімічним складом розчинених в них речовин вони не менш різноманітні, ніж інші природні води. Джерелом їх складу є аерозолі атмосфери. Іонний склад їх досить різноманітний. При коливаннях середньої багаторічної мінералізації атмосферних опадів в європейській частині Росії в межах 10-20 мг / л і екстремальних значеннях для всієї території 3-4 і 50-60 мг / л іонний склад характеризується строкатістю, причому серед аніонів здебільшого переважає SO 4 2- або HCO 3 -, а серед катіонів в залежності від ступеня віддаленості від узбережжя Ca 2+ або Na +. Безпосередньо біля узбережжя при вітрі, що дме з моря, в результаті вітрового механічного виносу солей концентрація хлору в опадах буває підвищеною. У міру віддалення від узбережжя відносна концентрація Cl - падає, а SO 4 2-, Ca 2+ і Mg 2+, навпаки, підвищується. Причиною підвищення вмісту SO 4 2- і Ca 2+ є збагачення атмосфери аерозолями континентального походження. У міру просування в глиб континенту частина морських аерозолів вимивається. Найбільші зміни відчуває концентрація SO 4 2-. Якщо збільшення вмісту Ca 2+ і Na + пов'язано, швидше за все, з мінеральною пилом грунтів і порід, на поверхні яких завжди присутні ці солі, то збільшення вмісту SO 4 2- обумовлено, з одного боку, окисленням SO 2 і H 2 S, з іншого - підняттям сірчанокислих солей з засолених поверхонь.
Не піддаються навіть приблизною оцінкою величезні кількості сольових частинок, що піднімаються з грунтів, солоних озер, поверхні льоду, добрив і, нарешті, що викидаються хімічними та металургійними виробництвами, і викидаються в атмосферу в результаті іншої діяльність людей, а в подальшому вимиваються опадами.
Води більшості річок належать до гидрокарбонатному класу. По складу катіонів ця вода має майже виключно переважання кальцію; гідрокарбонатні води з переважанням магнію і натрію - вкрай рідкісне явище. З природних вод гідрокарбонатно класу найбільш поширені води малої мінералізації (сумарний вміст солей до 200 мг / л).
Річки з водою, що відноситься до сульфатно класу, порівняно нечисленні. Вони поширені переважно в степовій смузі і частково в напівпустелях. У складі катіонів природних вод сульфатного класу, так само як і в водах гидрокарбонатного класу, переважає кальцій. Однак ряд річок сульфатного класу має переважання натрію. За мінералізацією води сульфатного класу значно перевершують води гідрокарбонатно класу. Річкові сульфатні води з малою (загальна кількість солей до 200 мг / л) і середньої (загальна кількість солей з 200 до 500 мг / л) мінералізацією зустрічаються порівняно рідко. Найбільш характерна для цих річок підвищена (загальна кількість солей з 500 до 1000 мг / л), а іноді і висока (загальна кількість солей більше 1000 мг / л) мінералізація води.
Річки, води яких відносяться до хлоридного класу, зустрічаються майже так само рідко, як і річки, в воді яких переважають сульфати. До цієї території відносяться переважно степові райони і напівпустелі. Переважаючими катіонами природних вод хлоридного класу є головним чином іони натрію. Води хлоридного класу відрізняються високою мінералізацією - понад 1000 мг / л, рідше від 500 до 1000 мг / л.
Наведена характеристика іонного складу річкової води відноситься до періоду літньої межені. До деякої міри вона характеризує склад і в період льодоставу. Істотно інша, значно менша мінералізація води спостерігається в період весняної повені.
У розподілі іонного складу річкової води на території Росії спостерігається певна закономірність. Є загальна тенденція до збільшення мінералізації води на більшій території європейської частини Росії з півночі на південь і з заходу на схід. Зональність іонного складу річкових вод пояснюється не тільки дією кліматичних умов теперішнього часу, але і в значній мірі кліматом минулого. Ступінь Вилужені грунтів і порід, наявність в них легкорозчинних солей або засоленість ґрунтів - це природний результат багатовікового впливу відповідних кліматичних умов. Порушують зональність хімічного складу води річок на території Росії відмінності складу порід і умов їх залягання.

Мінералізація і хімічний склад води озер на відміну від річок змінюється в дуже широких межах. Річки з мінералізацією води понад 100-200 мг / л, в яких би умовах вони не знаходилися, - дуже рідкісне явище, в той час як мінералізація води озер буває від дуже низької, в кілька десятків мг / л (тобто мало відрізняється від дощовому) до дуже високої 3-3,5% (соляні озера з розсолом вщерть насиченого солями). Різниця в мінералізації відбивається і на іонному складі води озер. У ньому спостерігаються закономірності, які властиві і хімічним складом річкової води. Зі збільшенням мінералізації озерної води відбувається відносне зростання іонів в її складі в такій послідовності: HCO 3 - → SO 4 2- → Cl -; Ca 2+ → Mg 2+ → Na +. При мінералізації до 500-1000 мг / л у складі озерної води переважають гідрокарбонатні іони, понад 0,1% - найчастіше сульфатні, а після досягнення 0,3-0,5% в залежності від літологічних особливостей водозбірної площі - сульфатні або хлоридні води . У складі катіонів озерних вод переважна роль кальцію зберігається лише до 0,1-0,2%. При подальшому зростанні мінералізації цю роль починають грати іони натрію. Іони магнію, так само як і у всіх інших водах, зберігають при всіх мінералізації проміжне положення. Причина подібного розподілу іонного складу полягає в різній розчинності солей. Переважна частина прісних озер, так само як і річок, за складом вод гідрокарбонатно-кальцієві.
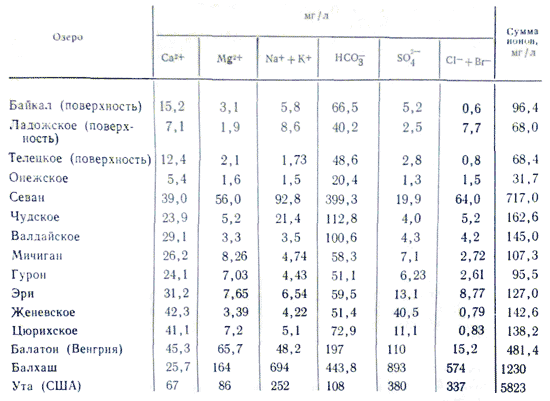
склад морської води характеризується великим вмістом солей. Якщо в водах материкового стоку найчастіше спостерігається співвідношення концентрацій: HCO 3 -\u003e SO 4 2-\u003e Cl - і Ca 2+\u003e Mg 2+\u003e Na + або Ca 2+\u003e Na +\u003e Mg 2+, то для солонуватих і морських вод, починаючи з загальної мінералізації 1 г / кг, співвідношення міняються :: Cl -\u003e SO 4 2-\u003e HCO 3 - і Na +\u003e Mg 2+\u003e Ca 2+. Зміна співвідношень між нонами від річкових до морських вод пояснюється послідовним досягненням межі розчинності слаборозчинних солей у міру підвищення мінералізації води. В сумі іони і з'єднання головних компонентів складають по масі 99,99% маси всіх розчинених в океанській воді мінеральних речовин.
Між елементами основного сольового складу океанської води, між кожним з них і їх сумою існує практичне сталість співвідношень концентрацій. Остаточно його довів У. Дітмар, який виконав повний хімічний аналіз (хлориди, сульфати, кальцій, магній, натрій) 77 проб води, доставлених з усіх океанів з різних глибин експедицією на "Челленджера": у воді відкритого океану незалежно від абсолютної концентрації кількісні співвідношення між головними компонентами основного сольового складу завжди постійні (закон Дітмара). Під впливом випаровування, атмосферних опадів, освіти і танення льодів змінюється лише загальна кількість солей, що містяться в морській воді, але їх співвідношення в межах похибок визначень практично не змінюються. Таким чином, якщо відома точна відношення загальної кількості солей і концентрацій всіх основних компонентів в 1 кг води до концентрації будь-якого одного інгредієнта, то лише по одному визначенню можна обчислити повний сольовий склад океанської води. В якості такого "реперного" інгредієнта обрано "хлорность", що представляє собою кількість грамів іонів хлору, еквівалентну сумі галогенів (крім фторидів, які не осідають азотнокислим сріблом), що містяться в 1 кг морської води (визначення Серенсена). Сталість складу океанської води злегка порушується під опріснюються впливом материкового стоку в пригирлових ділянках і у внутрішніх морях при утрудненому водообмене з океаном. У складі головних компонентів концентрації катіонів кальцію і магнію, а також сума концентрацій аніонів слабких кислот (HCO 3 -, CO 3 2-, H 2 BO 3 -) схильні до більш ніж на 1% відхилень від сталості співвідношенні в зв'язку з отриманням карбонату кальцію з води в поверхневих шарах і розчиненням його на глибинах.
Концентрації мікроелементів настільки малі, що в сумі вони не перевищують 0,01% маси всіх розчинених солей. З узагальнюючої зведення В.В. Гордєєва і А.П. Лісіцина слід, що в найбільших концентраціях зустрічаються літій (180 мкг / л), рубідій (120 мкг / л), барій (18 мкг / л), в найменших - золото (0,004 мкг / л), рідкоземельні елементи (менше 0,001 мкг / л), радій (10 -7 мкг / л).
Чим більше ізольовано море від океану, тим помітніше відрізняється склад його води від складу води в океані. Першорядне значення мають умови водообміну з океаном, співвідношення обсягу материкового стоку з об'ємом моря, глибина моря і характер хімічного складу вод впадають річок.
Підземні води відрізняються винятковою різноманітністю хімічного складу, в тому числі і іонного. Склад води буває всіх класів, груп і типів. Іонний склад підземних вод насамперед залежить від умов їх формування і залягання.
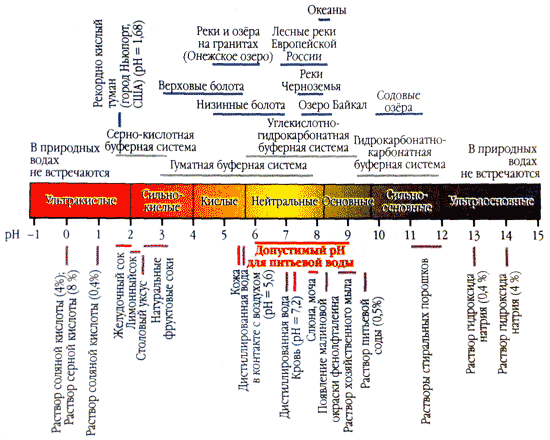
Природна вода здатна зберігати значення рН більш-менш постійним, навіть якщо в неї ззовні потрапляє певна кількість кислоти або підстави. Якщо в літр дистильованої води внести краплю концентрованої соляної кислоти, то рН знизиться з 7 до 4. А якщо краплю соляної кислоти додати в літр річкової води з рН \u003d 7, показник майже не зміниться. Кислоти і підстави, що потрапляють в природну воду, нейтралізуються розчиненими в ній вуглекислим газом і гідрокарбонат-іонами:
H + + HCO 3 - ↔ H 2 O + CO 2
OH - + CO 2 ↔ HCO 3 -
Гідрокарбонат-іони нейтралізують кислоти, що потрапляють у водойму з атмосферними опадами або утворюються в результаті життєдіяльності організмів. З концентрацією гідрокарбонат-іонів безпосередньо пов'язана стійкість водойм до кислотних дощів. Найбільш чутливі до них річки та озера Карелії, Фінляндії, Скандинавії, в водах яких цих іонів практично немає.
Органічною речовиною природних вод називають комплекс істинно розчинених і колоїдних речовин органічних сполук. За походженням органічні речовини природних вод можуть бути розділені на надходять ззовні (з водозбірної площі) і утворюються в самому водному об'єкті. До першої групи належать переважно гумусові речовини, що вимиваються водою з грунтів, торфовищ, лісового перегною і інших видів природних утворень, що включають залишки рослин, і органічні речовини, що надходять з промисловими і господарсько-побутовими стічними водами. З гумусових речовин для гідрохімії найбільший інтерес представляють гумінові і фульвокислоти. Обидві ці кислоти характерні для гумусу (гумусові кислоти), вони не містяться в живих рослинних і тваринних тканинах. Співвідношення між ними в різних торфу і грунтах неоднаково. У чорноземних грунтах переважають гумінові, а в підзолистих - фульвокіслоги.
Загальна концентрація органічної речовини в природних водах, змінюючись в широких межах, буває найбільшою в болотних водах (в яких при великій концентрації гумусових речовин вона іноді досягає 500 мг / л і більше) і річках з болотним харчуванням, причому болотна вода буває пофарбованої в жовтий і коричневий колір до 300 ° і вище по платиново-кобальтової шкалою кольоровості (забарвлення природній воді надають гумінові кислоти). Висока концентрація органічної речовини іноді зустрічається в підземних водах, пов'язаних з нафтоносними родовищами. Ще більша концентрація може бути в природних водах, забруднених промисловими і господарсько-побутовими стічними водами. Незабруднені природні води зазвичай містять мало органічних речовин. Наприклад, по Б.А. Скопинцева, в воді океанів концентрація органічної речовини становить тільки 2,0-5,4 мг / л (в середньому 3,0 мг / л, а в воді річок в середньому 20 мг / л).
У деяких поверхневих водах, особливо в річках з болотним харчуванням, речовини гумусового походження є основною частиною хімічного складу води. Після надходження в добре аеріруемие річки, а потім озера і моря органічні речовини води піддаються зміни, і розпочатий в грунтах процес окислення завершується для більшої їх частини переходом в прості мінеральні сполуки. Інша, більш стійка частина залишається і накопичується в водних об'єктах.
У холодних кліматичних зонах (тундрі) дуже мало органічних залишків, і там водойми майже не містять гумінових кислот. А в зоні лісів, особливо хвойних, де органічних залишків утворюється багато і вони не встигають повністю розкластися, зміст гуміноних кислот становить кілька десятків міліграмів на літр. Гумінові кислоти не тільки подкисляют воду у водоймі, але ще і пов'язують практично всі важкі метали в міцні комплексні сполуки.
Якщо налити в стакан холодну воду з-під крана і поставити в тепле місце, на стінках з'являться бульбашки газу. Гази були розчинені в холодній воді і виділилися при нагріванні (оскільки розчинність газів при нагріванні зменшується). Це кисень, азот і вуглекислий газ. Розчинність газу у воді зазвичай падає з підвищенням температури, що пов'язано з підвищенням кінетичної енергії молекул газу, що сприяє подоланню сил тяжіння молекул води. Всі природні води представляють газові розчини. Найбільш широко поширені в поверхневих водах кисень O 2 і двоокис вуглецю CO 2, а в підземних - сірководень H 2 S і метан CH 4. Іноді CO 2 в значних кількостях може насичувати також води глибоких горизонтів. Крім того, у всіх природних водах постійно присутній азот N 2.
Кисень (O 2) знаходиться в природній воді у вигляді розчинених молекул. Кисень, будучи потужним окислювачем, відіграє особливу роль у формуванні хімічного складу природних вод. Кисень надходить в воду в результаті відбуваються в природі процесів фотосинтезу і з атмосфери. Витрачається кисень на окислення органічних речовин, а також в процесі дихання організмів. Концентрація розчиненого кисню в природних водах коливається в обмежених межах (від 0 до 14 мг / л, при інтенсивному фотосинтезі, в полудень, можлива і більш висока концентрація). Внаслідок залежності концентрації кисню в поверхневих водах від цілого ряду чинників його концентрація значно змінюється протягом доби, сезону і року. Оскільки споживання кисню порівняно мало залежить від добових змін сонячної радіації, а фотосинтез цілком визначається нею, то протягом дня відбувається накопичення кисню, а в темний час доби витрачання його. Кисень необхідний для існування більшості організмів, що населяють водойми. Як сильний окислювач кисень відіграє важливу санітарно-гігієнічну роль, сприяючи швидкої мінералізації органічних залишків.
Діоксид вуглецю (CO 2) знаходиться у воді головним чином у вигляді розчинених молекул газу CO 2. Однак частина їх (близько 1%) вступає у взаємодію з водою, утворюючи вугільну кислоту:
CO 2 + H 2 O ↔ H 2 CO 3
Зазвичай же не поділяють CO 2 і H 2 CO 3 і під діоксидом вуглецю на увазі їх суму (CO 2 + H 2 CO 3). У природних водах джерелом діоксиду вуглецю є перш за все процеси окислення органічних речовин, що відбуваються з виділенням CO 2 як безпосередньо у воді, так і в грунтах і мулах, з якими стикається вода. До них відносяться дихання водних організмів і різні види біохімічного розпаду і окислення органічних залишків. У деяких підземних водах важливим джерелом діоксиду вуглецю є вулканічні гази, які виділяють з надр землі, походження яких пов'язане з дегазацією мантії і зі складними процесами метаморфизации осадових порід, що протікають в глибинах під впливом високої температури. Тому часто в підземних водах і джерелах глибинного походження спостерігається високий вміст діоксиду вуглецю. Поглинання водою діоксиду вуглецю з атмосфери має більш важливе значення для води морів і океану і менш значуще для вод суші. Зменшення вмісту діоксиду вуглецю насамперед відбувається при фотосинтезі. При дуже інтенсивному фотосинтезі, коли відзначається повне споживання газоподібного CO 2, останній може бути виділений з іонів HCO 3 -:
HCO 3 - ↔ CO 3 2- + CO 2
Діоксид вуглецю витрачається також на розчинення карбонатів:
CaCO 3 + CO 2 + H 2 O ↔ Ca (HCO 3) 2
Також витрачається на хімічне вивітрювання алюмосилікатів. Зменшення вмісту CO 2 в воді, особливо в поверхневих водах суші, відбувається також при виділенні його в атмосферу. Взагалі CO 2 атмосфери має велике значення для CO 2 міститься в поверхневих водах, регулюючи його зміст там. Між CO 2 атмосфери і CO 2 поверхневих вод існує безперервний обмін, спрямований на встановлення між ними рівноваги, відповідно до закону Генрі-Дальтона. Оскільки парціальний тиск діоксиду вуглецю в атмосфері дуже невелика (33 Па), то, незважаючи на велику розчинність його (при тиску 1013 гПа і температурі 12 ° С до 2166 мг / л), рівновагу між водою і атмосферою досягається при дуже малому вмісті CO 2 у воді. При парціальному тиску CO 2 в атмосфері 33 Па розчинність його у воді буде 2166.0,00033 \u003d 0,715 мг / л (при 12 ° С). Зазвичай же поверхневі води суші, в яких протікають різні процеси розкладання органічної речовини і які пов'язані з грунтами, мають більший вміст CO 2 і тому виділяють його в атмосферу. Лише при дуже сильному фотосинтезі, коли CO 2 практично зникає, може відбуватися поглинання CO 2 з атмосфери. Вміст діоксиду вуглецю в природних водах надзвичайно різноманітно - від декількох десятих долей до 3000-4000 мг / л. Найменша концентрація CO 2 спостерігається в поверхневих водах, особливо мінералізованих (моря, солоні озера), найбільша - у підземних та забруднених стічних водах. У річках і озерах концентрація CO 2 рідко перевищує 20-30 мг / л.
розчинений молекулярний азот (N 2) - найбільш постійний газ в природних водах. Надзвичайно хімічно стійкий і біологічно важко засвоюваний, азот, будучи занесений в глибинні шари океану або підземні води, змінюється головним чином лише під впливом фізичних умов (температура і тиск). Розчинений в поверхневих водах азот має переважно повітряне походження. Поряд з цим в природі широко поширений азот біогенного походження, що виникає в результаті денітрифікації.
газ метан (CH4) відноситься до числа найбільш поширених газів і підземних водах. У газовій фазі підземних вод майже завжди кількісно переважає азот, двоокис вуглецю або метан. Основним джерелом утворення метану служать дисперсні органічні речовини в породах. Метан і важкі вуглеводні, нерідко зустрічаються в значних концентраціях в глибинних підземних водах закритих структур, пов'язаних з нафтоносними родовищами. У невеликій концентрації метан спостерігається в природних шарах озер, де він виділяється з мулу при розкладанні рослинних залишків, а також в океанічних донних відкладеннях в районах високої біологічної продуктивності.
газ сірководень (H 2 S) є одним з продуктів розпаду білкової речовини, що містить в своєму складі сірку, і тому скупчення його часто спостерігається в придонних шарах водойм внаслідок гниття різних органічних залишків. У нижніх частинах глибоких озер і морів, де відсутня водообмін, часто утворюється сірководнева зона. При парціальному тиску сірководню в атмосфері, що дорівнює нулю, тривала присутність його в поверхневих водах неможливо. Крім того, він окислюється киснем, розчиненим у воді. У річках сірководень спостерігається лише в придонних шарах, головним чином в зимовий період, коли утруднена аерація водної товщі. Присутність сірководню в природних незабруднених поверхневих водах - порівняно рідкісне явище. Набагато частіше сірководень присутній в підземних водах, ізольованих від поверхні і в сильно забруднених поверхневих водах, в яких він служить показником сильного забруднення і анаеробних умови.
Крім головних іонів, вміст яких у воді дуже багато, ряд елементів: азот, фосфор, кремній, алюміній, залізо, фтор - присутні в ній в концентраціях від 0,1 до 10 мг / л. Вони називаються мезоелементамі (від грец. "Мезос" - "середній", "проміжний").
Азот у формі нітратів NO 3 - потрапляє у водойми з дощовою водою, а в формі амінокислот, сечовини (NH 2) 2 CO і солей амонію NH 4 + - при розкладанні органічних залишків.
Фосфор існує в воді в формі гидрофосфата HPO 3 2- і дигідрофосфат H 2 PO 3 -, що утворюються в результаті розкладання органічних залишків.
Кремній є постійним компонентом хімічного складу природних вод. Цьому сприяє на відміну від інших компонентів поширеність сполук кремнію в гірських породах, і тільки мала розчинність останніх пояснює малий вміст кремнію в воді. Концентрація кремнію в природних водах зазвичай становить кілька міліграмів в 1 л. У підземних водах вона підвищується і часто досягає десятків міліграмів в 1 л, а в гарячих термальних водах - навіть сотень. На розчинність кремнію, крім температури сильно впливає підвищення pH розчину. Порівняно малий вміст кремнію в поверхневих водах, що поступаються розчинності діоксиду кремнію (125 мг / л при 26 ° С, 170 мг / л при 38 ° С), вказує на наявність у воді процесів зменшують його концентрацію. До них треба віднести споживання кремнію водяними організмами, багато з яких, наприклад діатомові водорості, будують свій скелет із кремнію. Крім того, кремнієва кислота як більш слабка витісняється з розчину вугільною кислотою:
Na 4 SiO 4 + 4CO 2 + 4H 2 O \u003d H 4 SiO 4 + 4NaHCO 3
Сприяє нестійкості кремнію в розчині і схильність кремнієвої кислоти за певних умов переходити в гель. У дуже мало мінералізованих водах кремній становить істотну, а іноді і переважну частину хімічного складу води, незважаючи на його малу абсолютний зміст. Присутність кремнію у воді є серйозною перешкодою в техніці, так як при тривалому кип'ятінні води кремній утворює в котлах дуже тверду силікатну накип.
Алюміній надходить у водойми в результаті дії кислот на глини (каолін):
Al 2 (OH) 4 + 6H + \u003d 2SiO 2 + 5H 2 O + 2Al 3+
Основне джерело заліза - залізовмісні глини. Органічні залишки (нижче позначаються як "С"), що знаходяться в контакті з ними, відновлюють залізо до двовалентного, яке повільно вимивається в формі гідрокарбонату або солей гумінових кислот:
2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 \u003d 4Fe (HCO 3) 2
Коли вода з розчиненими в ній іонами Fe 2+ вступає в контакт з повітрям, залізо швидко окислюється, утворюючи коричневий осад гідроксиду Fe (OH) 3. Згодом він перетворюється в болотяну руду - бурий залізняк (лимонит) FeO (OH). Карельська болотна руда використовувалася в XVIII-XIX століттях для отримання заліза.
Синювата плівка на поверхні води - це Fe (OH) 3, що утворюється, коли підземні води, що містили іони Fe 2+, вступають в контакт з повітрям. Її часто плутають з масляною плівкою, проте розрізнити їх дуже легко: у плівки гідроксиду заліза рвані краї. Якщо поверхня води злегка схвилювати, гідроксидні плівка, на відміну від масляної, що не буде переливатися.
До цієї групи належать елементи, з'єднання яких зустрічаються в природних водах в дуже малих концентраціях, тому їх і називають мікроелементами. Їх концентрація вимірюється мікрограма в 1 л (мкг / л), а часто має і менші значення. Мікроелементи є найбільшу групу елементів хімічного складу природних вод, в неї входять всі елементи періодичної системи, не включені в попередні групи розглянутих компонентів. Умовно їх можна розділити на п'ять підгруп: 1) типові катіони (Li +, Rb +, Cs +, Be 2+, Sr 2+, Ba 2+ і ін.); 2) іони важких металів (Cu 2+, Ag +, Au +, Pb 2+, Fe 2+, Ni 2+, Co 2+ та ін); 3) амфотерні комплексообразователи (Cr, Mo, V, Mn); 4) типові аніони (Br -, I -, F -); 5) радіоактивні елементи. Мікроелементи необхідні для нормальної життєдіяльності рослин, тварин і людини. Однак при підвищеній концентрації багато мікроелементів шкідливі і навіть отруйні для живих організмів. Тому часто вони стають забруднюючими речовинами і концентрація їх контролюється. Успішне вивчення мікроелементів утруднено не тільки їх малим вмістом в природних водах, а й в сильній мірі неясністю форми їх присутності в розчині. Останнє не тільки ускладнює з'ясування закономірностей їх міграції і режиму але і створює труднощі при хімічному аналізі. Наприклад, багато важкі метали мігрують у великих концентраціях саме в підвішеному, а не в розчиненому стані. Розчинені органічні комплекси утворюють більшість металів, перш за все двох-і тривалентні метали з гуміновими і фульвокислот. Концентрація закомплексованих металів визначається насамперед концентрацією органічних кислот. У вигляді колоїдних сполук присутні багато гідроксиди металів. Можливо, відбувається адсорбція органічних речовин на поверхні колоїдів, що надає їм більшу стабільність в розчині.
Хімічний склад природної води визначає попередня йому історія, тобто шлях, досконалий водою в процесі свого кругообігу. Кількість розчинених речовин в такій воді буде залежати, з одного боку, від складу тих речовин, з якими вона стикалася, з іншого - від умов, в яких відбувалися ці взаємодії. Впливати на хімічний склад води можуть наступні фактори: гірські породи, грунту, живі організми, діяльність людини, клімат, рельєф, водний режим, рослинність, гідрогеологічні та гідродинамічні умови тощо. Розглянемо лише деякі фактори, що впливають на склад води.
Грунтовий розчин і фільтруються через грунт атмосферні опади здатні посилювати розчинення порід і мінералів. Це одне з найважливіших властивостей грунту, що впливає на формування складу природних вод, є результатом збільшення концентрації діоксиду вуглецю в грунтовому розчині, що виділяється при диханні живих організмів і кореневої системи в грунтах і біохімічному розпаді органічних залишків. Внаслідок цього концентрація CO 2 в грунтовому повітрі зростає від 0,033%, властивих атмосферному повітрю, до 1% і більше в грунтовому повітрі (в важких глинистих ґрунтах концентрація CO 2 в грунтовому повітрі досягає іноді 5-10%, надаючи тим самим розчину сильне агресивна дія по відношенню до порід). Іншим фактором, що підсилює агресивна дія фільтрується через грунт води, є органічна речовина - грунтовий гумус, що утворюється в грунтах при трансформації рослинних залишків. У складі гумусу в якості активних реагентів насамперед слід назвати гумінові і фульвокислоти і більш прості з'єднання, наприклад органічні кислоти (лимонна, щавлева, оцтова, яблучна і ін.), Аміни і т.п. Грунтовий розчин, збагачуючись органічними кислотами і CO 2, у багато разів прискорює хімічне вивітрювання алюмосилікатів, що містяться в грунтах. Аналогічно вода, фільтруються через грунт, прискорює хімічне вивітрювання алюмосилікатів і карбонатних порід, що підстилають ґрунт. Вапняк легко утворює розчинний (до 1,6 г / л) гідрокарбонат кальцію:
CaCO 3 + H 2 O + CO 2 ↔ Ca (HCO 3) 2
Майже на всій європейській частині Росії (крім Карелії і Мурманської області) вапняки, а також доломіт MgCO 3 .CaCO 3 залягають досить близько до поверхні. Тому вода тут містить переважно гідрокарбонати кальцію і магнію. У таких річках, як Волга, Дон, Північна Двіна, і основних їх притоках гідрокарбонати кальцію і магнію складають від 3/4 до 9/10 всіх розчинених солей.
Солі потрапляють у водойми і в результаті діяльності людини. Так, хлоридами натрію і кальцію взимку посипають дороги, щоб розтоплювати лід. Навесні разом з талою водою хлориди стікають в річки. Третина хлоридів в річках європейської частини Росії привнесена туди людиною. У річках, на яких стоять великі міста, ця частка набагато більше.
Рельєф місцевості побічно впливає на склад води, сприяючи вимивання солей з товщі порід. Глибина ерозійного врізу річки полегшує надходження в річку більш мінералізованих грунтових вод нижніх горизонтів. Цьому ж сприяють і інші види депресій (річкові долини, балки, яри), що поліпшують дренування водозбору.
Клімат ж, створює загальний фон, на якому відбувається більшість процесів, що впливають на формування хімічного складу природних вод. Клімат насамперед визначає баланс тепла і вологи, від якого залежить зволоженість місцевості і обсяг водного стоку, а отже, і розведення або концентрування природних розчинів і можливість розчинення речовин або випадання їх в осад.
Величезний вплив на хімічний склад води і його зміна з плином часу надають джерела живлення водного об'єкта і їх співвідношення. У період танення снігу вода в річках, озерах і водосховищах має нижчу мінералізацію, ніж в період, коли більша частина харчування здійснюється за рахунок грунтових і підземних вод. Ця обставина використовують при регулюванні наповнення водосховищ і скидання з них води. Як правило, водосховища наповнюють в період весняної повені, коли припливна вода має меншу мінералізацію.
Хімічний склад води може бути дуже різним, тому що залежить від вмісту часток неорганічних і органічних речовин. Протікаючи в різних шарах землі, вода розчиняє солі (кальцію, магнію, заліза і т.д.), насичуючись ними.
Розташовуючись на поверхні землі, вода стикається з газами, розчиняючи їх. Навіть природні води відрізняються за хімічним складом один від одного, так як його формують розчинені у воді гази, основні іони, біогенні і органічні речовини, мікроелементи.
Великий вплив на якість води та її хімічний склад робить грунт ложа ставка. Вода вимиває з грунту мінеральні та органічні речовини, що особливо виразно спостерігається в перші роки експлуатації ставка.
Газовий режим в природних і штучних водоймах формується за рахунок газів, які потрапляють у воду з атмосфери і в результаті хімічних процесів. Кількість розчинених газів залежить від температури, тиску і наявності у воді солей.
Деякі гази, а це в першу чергу кисень і вуглекислий газ, просто необхідні для життєдіяльності водних організмів. Чим їх більше в воді, тим краще для мешканців водойми. Навпаки, велика кількість сірководню, метану та азоту пригнічує життєдіяльність живих істот.
Один з найважливіших розчинних газів, постійно присутніх в поверхневих водах - це кисень. Його кількість в значній мірі залежить від хіміко-біологічного стану водойми.
Головними джерелами насичення води киснем є
- атмосфера-під впливом вітру повітря змішується з поверхневими шарами води;
- фотосинтез мікроскопічних водоростей.
В умовах високої температури розчинність кисню у воді зменшується, а при низькій температурі збільшується.
Насичення води киснем в природних умовах зазвичай нижче 100%, тому що велика кількість цього газу йде на окислення органічних речовин. При масовому розвитку водоростей (в сонячні дні) в деяких водоймах насичення киснем може досягати 150-200%.
Вуглекислий газ (СО 2) в певних кількостях міститься майже у всіх природних водах. При цьому велика частина вуглекислого газу знаходиться в розчиненому стані, а незначна кількість (до 1%) може взаємодіяти з водою і створювати вугільну кислоту.
Підвищення концентрації вуглекислоти вище оптимального рівня свідчить про забруднення ставка органічними речовинами. Особливо важливо регулювати співвідношення кисню і вуглекислоти.
Щоб мати уявлення про хімічний склад води і характер його зміни, час від часу слід проводити лабораторні аналізи. Основну інформацію про якість води можна отримати за допомогою спеціального тестирующего приладу. представляє собою прозорий блок з двома кюветами і колірною шкалою.
Під дією тих чи інших хімікатів тестована вода набуває певного відтінку, який порівнюють з колірним поділом шкали. Кожному кольору шкали відповідає певний рівень кислотності води.
Кислотність води (рН) характеризує активну реакцію середовища. Чим ближче значення рН до нуля, тим вище концентрація водневих іонів в розчині, тим більше кислою є середовище.
Оптимальний показник кислотності води для людини знаходиться в досить вузькому діапазоні 7,2-7,4, максимум 7,6. При такому рівні рН вода не має шкідливого впливу на шкірний покрив людини і перешкоджає розмноженню мікроорганізмів.
Якщо показник рН вище 7,8, то така вода подразнює шкіру (особливо чутливу) і в воді рясно розмножуються мікроорганізми. Крім того, високий рівень рН підвищує корозійну активність води, що в значній мірі позначається на працездатності обладнання і комунікацій.
Найбільші показники рН води (8-8,8) спостерігаються в другій половині вегетаційного періоду, коли біомаса водоростей досягає найбільшого розвитку, а процеси фотосинтезу відбуваються з максимальною інтенсивністю.
Внаслідок хімічних реакцій, що відбуваються в воді. рівень рН постійно змінюється, причому не тільки на протязі року, а й протягом окремо взятих діб.
На рівень рН великий вплив робить жорсткість води. Так, в м'якій воді рівень рН менше 7, 0, а в жорсткій може досягати 9,0.
Жорсткість води обумовлена \u200b\u200bзмістом в ній в основному Са СО2 (). яка при температурних змінах випадає в осад на стінках басейну, фільтрах, теплообмінниках і іншому устаткуванні.
У відповідності зі стандартами жорсткість води не повинна перевищувати 30 ° dH, де 1 ° dН \u003d 10 мг СаО / л. Жорсткість води може змінюватися в залежності від пори року. Взимку і в дощові періоди вона дещо знижується.
Окислення води свідчить про вміст у ній розчинних органічних і мінеральних речовин.
Величина окислення показує, скільки витрачається кисню на руйнування органічних речовин (мг / л). Протягом усього вегетаційного сезону окисленность води змінюється від 10 до 30 мг 1 л і більше.
Хімічний склад води. У природі вода практично завжди містить більшу або меншу кількість розчинених у ній мінеральних солей. ступінь і мінеральний склад води визначаються характером грунту або ґрунтів, прилеглих до водоносних шарів або поверхневим вододжерел.
Кількість мінеральних солей, що містяться у воді, виражається в мг / л.
Органічні речовини. З них найважливіші - речовини тваринного походження, оскільки саме вони можуть містити різні патогенні мікроби. Непрямим гігієнічним показником наявності чи відсутності цих речовин у воді служить окислюваність води.
Окислюваність води. Ця кількість кисню (мг), що витрачається на повне окислення органічних речовин, що містяться в 1 л води (позначається - мг / л). Чим менше в воді органічних речовин, тим менше величина витрат кисню на повне окислення містяться в 1 л води органічних речовин. Наприклад, окислюваність чистих підземних вод, як правило, не буває більше 2-4 мг / л, річкових - в межах 7 мг / л.
Одним з показників можливої \u200b\u200bприсутності у воді органічних речовин служить кількість розчиненого в ній кисню (мг). У чистих водоймах розчинено 3-6 мг / л кисню, а в забруднених - набагато менше, аж до повної відсутності.
Про можливе забруднення води органічними речовинами тваринного походження свідчить наявність аміаку, солей азотної та азотної кислот. Аміак - це продукт початкових стадій гниття органічних речовин тваринного походження, а солі азотної і азотистої кислот - кінцеві продукти мінералізації органічних речовин. Їх наявність вказує на давнє забруднення води.
Присутність у воді солей соляної і сірчаної кислот - показник можливого забруднення води екскрементами тварин і людини (фекального забруднення). Зазвичай в 1 л чистої природної води міститься не більше 20-30 мг хлоридів.
Жорсткість води. Вона визначається вмістом в ній солей кальцію і магнію. Розрізняють воду м'яку, помірно жорстку і жорстку. Виділяють загальну жорсткість води - жорсткість сирої води, переборні жорсткість, що зменшується при кип'ятінні або відстоюванні, і фатальна, що не знижується навіть після кип'ятіння води.
У жорсткій воді погано розварюються овочі і м'ясо, тому що знаходяться в них білки утворюють з кальцієм і магнієм нерозчинні сполуки, що не засвоюються в кишечнику людини.
Така вода не підходить і для гігієнічних процедур: наявність в ній надлишкової кількості солей перешкоджає піноутворення, нерозчинні сполуки осідають на волоссі і ускладнюють процес миття.
Жорсткість питної води не повинна перевищувати 7 мг / л. Цю характеристику можна вимірювати і в градусах (1 мг / екв жорсткості води дорівнює 2,8 °). Жорсткої вважається вода, що має більше 20 °, м'якою - менше 10 °.
Солі заліза. Вода, що містить залізо, нешкідлива, але в надмірних кількостях воно надає їй гіркуватий металевий смак і жовту або жовто-бурого забарвлення, знижуючи прозорість. У питній воді допускається до 0,5 мг / л заліза (у відкритих водоймах) і 1,0 мг / л (в підземних джерелах).
Фтор. Що міститься в питній воді, він значно впливає на стан зубів. При його підвищеної концентрації виникає флюороз (поява темних плям на емалі зубів), що веде до повного їх руйнування, а при недостатньому вмісті частішає захворюваність карієсом. У воді повинно знаходитися не більше 1,5 мг / л фтору, оптимальна кількість - 0,7-1,0 мг / л. Якщо фтору не вистачає, воду штучно фторують, т. Е. Додають фтористий натрій.
У природних (наземних) водоймах йдуть природні процеси самоочищення, якщо людина цього не перешкоджає:
* Знезараження ультрафіолетовими променями;
* Осадження і відстоювання зважених часток;
* Окислення органічних речовин за рахунок O2;
* Мінералізація органічних залишків за рахунок бактерій.
сторінка 1
Склад річкових вод визначається кількістю і якістю надходять в них речовин з грунту і повітря, а також стічних вод від промислових та комунальних підприємств.
Класифікація складу річкової води, наведена на рис. 3.24, є спрощеною і не завжди відповідає дійсності.
Як показали багаторічні дослідження складу річкової води, регульований скид вод накопичувача не викликає скільки-небудь помітних змін в якості річкової води, які можуть бути встановлені сучасними методами аналізу.
Зазначені сезонні особливості зміни складу річкових вод слід враховувати при проектуванні обладнання. Кожен клас по переважному катиону підрозділяється на три групи: кальцієву, магнієву і натрієву. У свою чергу кожна група поділяється на чотири типи вод, що визначаються кількісним співвідношенням іонів. Крім зазначених катіонів, річкові води містять також іони К, NH4, Fe2, Mn2, Cu2, Zn2, Ni2, Fe3, Al3 і в менших концентраціях ряд інших іонів.
Щоб з'ясувати характер зміни властивостей і складу річкової води при русі по нафтоносних пластів, в 1957 р співробітники ТатНІПІнефть відкрили п'ять нагнітальних свердловин на самоізлів.
поблизу населених пунктів і промислових підприємств на склад річкової води великий вплив можуть надавати промисло-но-побутові стоки.
З наведених у табл. 3 цифр видно, що склад річкових вод змінюється в досить широких межах. Річкові води, які течуть по зволоженим районам, в достатку містять карбонати і значна кількість кальцію. Річкові води, які течуть по посушливим районам (наприклад, по західній частині США), містять більше сульфатів, менше кальцію і значно менше карбонату. Було б неправильно обійти мовчанням кількість органічної речовини, яке переноситься водами, оскільки ця речовина в кінці кінців перетворюється в нафту.
Хімічний склад підземних вод берегових водозаборів зазвичай в тій чи іншій мірі відображає склад річкових вод, який, в свою чергу, визначається складом атмосферних опадів, а також складом снігового, зливового і підземного стоків. В атмосфері дощові води і сніг збагачуються в невеликій кількості киснем, вуглекислим газом, окисом азоту, солями амонію, а в забрудненому повітрі промислових районів, як зазначалося вище, до них додаються пил, бактерії, сірка, продукти згоряння вугілля і нафти та інші речовини.
В результаті, що надходять в річку навіть порівняно невеликі кількості забруднених стічних вод викликають таке погіршення складу цеженних річкових вод, яке виключає можливість подальшого цх використання.
Вони зустрічаються у вигляді мінералів, напр, гіпс Са8О4 - 2Н2О, мирабилит На28О4 - 10Н2О, а також входять до складу морської та річкової води.
Поверхневі річкові води (а також озерні і ставкові) характеризуються мінливістю свого складу, яка відбувається в результаті життєдіяльності знаходяться в воді рослинних і тваринних організмів, а головним чином весняних паводків і дощів, змиваючих з берегів значні кількості частинок грунту. Нарешті, поблизу населених пунктів на склад річкової води нерідко значно впливає спуск стічних вод і відходів промислових підприємств.
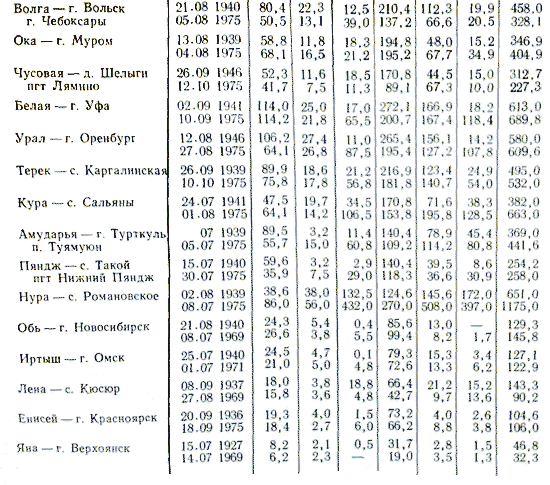
Хімічний склад річок відчуває сезонні коливання. Найбільша мінералізація річкової води спостерігається взимку під час харчування річок грунтовими водами, найменша - зазвичай під час повені, сезону дощів або харчування від танення льодовиків. Склад річкових вод залежить від фізико-географічних умов. У зонах надмірного зволоження мінералізація вод невелика. Змінюється мінералізація також вздовж течії річки в залежності від її приток, водозбір яких знаходиться в інших умовах формування.
Склад річкової води, як і її витрата, залежить від пори року. Найменша каламутність і найбільша мінералізація спостерігаються в зимовий час, зворотна картина - в періоди паводків, особливо весняних. В інші пори року на склад річкової води впливають метеорологічні умови, літні паводки та інші фактори.
Хімічний склад природних вод дуже складний. У них виявляється більшість відомих хімічних елементів, що обчислюються частками грамів або цілими і навіть десятками і сотнями грамів на літр води. Деякі з виявлених у воді елементів присутні у вигляді іонів або молекул, інші утворюють складні сполуки, в тому числі органічні.
Ступінь і характер мінералізації води в тій чи іншій місцевості відрізняється відомим постійністю. Загальний вміст розчинених у воді нелетких мінеральних і частково органічних речовин характеризує величина сухого залишку (головним чином, сукупність хлоридів, сульфатів, карбонатів і бікарбонатів, лужних і лужноземельних металів). Води, що містять підвищені кількості мінеральних солей можуть набувати неприємний солоний або гірко-солоний смак, тому рівень сухого залишку питних вод обмежується санітарної практикою в силу його впливу на смакові властивості води на рівні 1000 мг / л. Експериментальні дослідження показали, що оптимальною (за органолептичними властивостями) є питна вода, що містить 200-400 мг солей в 1 літрі. Воду з сухим залишком до 1000 мг / л називають прісною, понад 1000 мг / л - мінералізованою.
Зміни звичайного рівня мінералізації води, не пов'язані з природними причинами (весняні паводки), можуть розглядатися як показник забруднення води сторонніми речовинами.
Хлориди в воді зустрічаються переважно у вигляді хлористого натрію і рідше у вигляді інших з'єднань (хлористий магній і ін.). У природних водах хлориди з'являються в результаті вимивання їх з земельних порід. Особливо багато хлоридів міститься в місцях з солончакової грунтом. Хлориди мають значення як речовини, що змінюють смак води і впливають на фізіологічні функції організму. Починаючи з концентрації 500 мг / л, хлориди викликають пригнічення шлункової секреції, що виражається в зменшенні кислотності і перетравлює сили шлункового соку. Поряд з цим, прискорюється евакуація їжі зі шлунка. При концентрації більше 1000 мг / л хлориди призводять до зменшення діурезу, що може виявитися особливо шкідливим для людей, які страждають хворобами серця і нирок. У концентраціях більше 350 мг / л хлориди надають воді солонуватий присмак.
Хлориди можуть потрапляти у води з фекаліями, сечею, кухонними покидьками, тому для джерел місцевого водопостачання, вода яких не піддаються знезараженню, хлориди мають значення як непрямий індикатор побутового забруднення води. При цьому оцінюється не стільки концентрація хлоридів, скільки її зміна в часі і протягом вододжерела, тобто збільшення в порівнянні зі звичайними, характерними для даної місцевості концентраціями. Спільне присутність хлоридів і аміаку в поєднанні з високою окисляемостью і несприятливими бактеріологічними показниками вказує на санітарний неблагополуччя даного вододжерела.
Сульфати в кількостях, що перевищують 500 мг / л, надають воді гіркувато-солонуватий присмак, при концентрації 1000-1500 мг / л і вище пригнічують шлункову секрецію, надають послаблюючу дію на кишечник, викликають негативне ставлення людей до смаковими якостями води. Сульфати можуть бути показником забруднення поверхневих вод тваринами покидьками, так як складовою частиною білкових тіл є сірка, яка при розкладанні і подальшому окисленні перетворюється в солі сірчаної кислоти.
Жорсткість води показує концентрацію в ній катіонів двовалентних лужноземельних металів, перш за все кальцію і магнію. Іони Са (2+) і Мg (2+) можуть бути пов'язані з різними аніонами (HCO 3, SO 4, Cl, CO 3, HNO 3 та ін.).
Гідрокарбонати кальцію і магнію Са (НСО 3) 2, Мg (НСО 3) 2 і карбонати СаСО 3, МgСО 3 визначають карбонатну жорсткість. При нагріванні води порушується карбонатное рівновагу (зменшується вміст СО 2), внаслідок чого гідрокарбонати переходять у карбонати.
Розчинність карбонатів кальцію і магнію значно менше, ніж гідрокарбонатів, тому при кип'ятінні води жорсткість знижується. Жорсткість води, зумовлена \u200b\u200bгідрокарбонатами кальцію і магнію, називається карбонатної. Карбонатна жорсткість нерідко збігається з усуненою жорсткістю, але прирівнювати їх один до одного не можна. При великій кількості у воді гідрокарбонату магнію різниця між карбонатною і усуненою жорсткістю буває досить значною. З величиною усуненою жорсткості практично збігається лужність води, яка обумовлена \u200b\u200bзмістом в ній гідрокарбонатів лужноземельних металів (Са, Na, Мg, К,) та інших солей слабких кислот. Лужність води має значення для процесу коагуляції води при її очищенні. Різниця між загальною і усуненою жорсткістю називається постійною жорсткістю, Вона пов'язана з кількістю кальцію і магнію, пов'язаним з іншими аніонами крім, гідрокарбонатів (Сl, SO 4, NO 3 і ін.).
Жорсткість води є одним з істотних критеріїв якості питної води. Жорстка вода небажана для господарсько-побутових цілей: в жорсткій воді погано розварюються овочі, м'ясо, псується зовнішній вигляд, Смак і якість чаю, погано милиться мило, так як натрій в ньому заміщається кальцієм і магнієм води, в результаті чого утворюється пластівчастий осад кальцієвого і магнієвого мила. Жорстка вода може викликати хворобливе роздратування і сухість шкіри; в нагрівальних приладах в системах гарячого водопостачання жорстка вода утворює нерозчинний осад, що утруднює їх експлуатацію.
Що стосується впливу на здоров'я, то високу жорсткість слід розглядати як один з факторів, що сприяють розвитку уролітіазу, про що сказана вище. Протягом тривалого часу обговорюється питання про вплив жорсткості на серцево-судинну систему; є дані про більш високу смертність від серцево-судинних захворювань при використанні м'яких питних вод. Однак ця гіпотеза в ряді країн не знайшла підтвердження.
Залізо є невід'ємною частиною тваринного організму і використовується для побудови дихальних ферментів (гемоглобіну, каталази та ін.). Виділяється з організму залізо через кишечник. Організм задовольняє свої потреби в залозі в основному споживаючи його з їжею, тому то кількість його, яке надходить в організм з питною водою, Не має істотного фізіологічного значення. Залізо Fе (2+), Fе (3+) в різних концентраціях міститься в усіх природних вододжерела. У великих концентраціях воно з'являється в водоймах в результаті надходження виробничих стічних вод. При розподілі води по сталевих (неоцинкована) трубах вміст заліза в ній збільшується в результаті корозії. Токсична дія заліза на організм невідомо. При тривалому пероральному надходженні в організм навіть великих доз (300 мг / кг і більше) спостерігалися лише явища гастроентериту без ознак інтоксикації. Тому присутність заліза у воді небажано з естетичних і побутовим міркувань, так воно надає воді каламутність, забарвлення, гіркуватий присмак металу. Крім того, підвищені концентрації заліза у воді сприяють розвитку железобактерий, при відмирання яких всередині водопровідних труб накопичується щільний осад, що зменшує їх діаметр. Встановлено, що погіршення прозорості і кольоровості води відбувається під впливом як закисних, так і окисних сполук заліза, оскільки у всіх випадках вони викликають утворення гідроксиду заліза. При зменшенні концентрації заліза до 0,3 мг / л прозорість і кольоровість води знаходяться на рівні стандарту. Металевий присмак води зникає при концентрації заліза 0,5 мг / л. Дані, отримані методом опитування населення, свідчить про те, що при значно більшому вмісті заліза (більше 1,0 мг / л) вода може надавати дратівливу дію на шкіру людини, викликаючи свербіж і сухість.
Для приведення якості води у відповідність до вимог стандарту на водоочисних спорудах застосовуються спеціальні методи поліпшення якості води. Для зменшення в воді вмісту сульфатів, хлоридів та інших солей використовується опріснення води з подальшим додаванням розчинів солей. Опріснення здійснюється методами дистиляції, іонного обміну, електродіаліз. В умовах місцевого водопостачання використовується метод виморожування природним холодом і штучним заморожуванням.
Для знезалізнення води використовуються наступні методи: аерація (окислення) і вапнування з подальшим видаленням випала гідроксиду заліза шляхом відстоювання і фільтрації: а також використовується коагуляція води і катіонірованіе.
Для пом'якшення води (повного або часткового видалення з води катіонів Са (2+) і Мg (2+) використовуються реагентні методи, засновані на обробці води речовинами, що утворюють з іонами кальцію і магнію практично нерозчинні сполуки, що випадають в осад (для цього використовується додавання гашеного вапна в поєднанні з содою). Практичне застосування отримав також метод іонного обміну для пом'якшення води з використанням іонообмінних смол. Пом'якшення води методом іонного обміну може бути здійснено Nа-катіонуванням, Н-катіонуванням, паралельним або послідовним Н-Nа-катіонуванням.
У санітарно-хімічному аналізі води велику роль грає визначення солей аміаку, азотної та азотної кислот (нітритів і нітратів), що є непрямим показником забруднення води органічними речовинами тваринного походження.
Органічні речовини тваринної природи, що надходять в вододжерела, піддаються розпаду, відбувається мінералізація їх за рахунок населяють воду мікроорганізмів. Цей процес протікає більш інтенсивно в теплу пору року і при наявності у воді розчиненого кисню. Мінералізація азотовмісних органічних речовин йде в дві фази. В першу фазу, що носить назву аммонификации, білки і сечовина розпадаються до аміаку і його солей. Розпад білків протікає під впливом анаеробів (B.putrificus, B.sporogenes і ін.), Факультативних анаеробів (B.micoides і ін.), Аеробів (B.mesentericus, B.subtilis і ін.). Амоніфікація сечовини здійснюється уробактерій і ін. Мікробами. Оскільки аміак є початковим продуктом розкладання, то його присутність говорить про свіжому органічному забрудненні вододжерела.
У другій фазі мінералізації - нітрифікації - аміак і його солі окислюються до нітритів (за допомогою B.nitrosomonas), а вони в свою чергу окислюються до нітратів (за допомогою B.nitrobakter). Для перетворення амонійних солей в нітрити потрібен якийсь час ознакою недавнього забруднення води органічними речовинами. Нітрати - кінцевий продукт мінералізації органічних речовин, отже їх присутність є показником давнього забруднення вододжерела.
Азотовмісні речовини дозволяють констатувати не тільки наявність забруднення води, але і судити про давність забруднення. Так, якщо виявлений у воді аміак при повторних аналізах більше не зустрічається, то можна зробити висновок, що вода була забруднена випадково і більше не забруднюється. Якщо ж разом з аміаком в воді виявляються нітрити, то це вказує на те, що має місце систематичне забруднення води з недавнього часу. А якщо у воді виявляється аміак, нітрити та нітрати, то це вказує на крайнє неблагополуччя вододжерела, так як свідчить про давнє і постійному забрудненні вододжерела.
Якщо ж у воді виявляються нітрати, а аміак і нітрити відсутні, то це вказує на те, що завершилися процеси мінералізації органічних речовин, і отже, забруднення ліквідовано.
Слід враховувати, однак, що забруднення води органічними речовинами тваринного походження не є єдиною причиною появи у воді азотовмісних речовин. У чистих глибоко залягають водах кисень може зовсім відсутні, чим створюються умови для відновлення нітратів мінерального походження в нітрити і аміак. В цьому випадку підвищені концентрації сольового аміаку і нітритів у глибоких міжпластовому водах не є показником забруднення. Інші показники забруднення води при цьому будуть відсутні.
У воді відкритих водойм амонійні солі, нітрити та нітрати можуть бути рослинного походження, будучи продуктами розпаду органічних речовин водної рослинності. Азотовмісні речовини можуть потрапляти в вододжерела з промисловими стічними водами, а також зі стоками з територій, рясно удобрюваних азотсодержащими сполуками.
Таким чином, для правильної гігієнічної оцінки наявності азотовмісних речовин у воді необхідно встановити причину їх появи у воді. Про забруднення органічними речовинами тваринного походження можна з упевненістю говорити лише в тому випадку, якщо паралельно з мінеральними азотсодержащими сполуками у воді виявляються і інші показники забруднення: хімічні (висока окислюваність) і мікробіологічне (низький коли-титр, високий колі-індекс). В водопровідній воді, Яка піддається знезараженню, амонійні солі та нітрити як непрямі показники епідеміологічного неблагополуччя води втрачають своє значення. Однак, в знезаражують хлором водопровідній воді небажано зміст амонійних солей більше 0,5 мг / л, тому що через утворення менш активних речовин - хлораминов, витрата хлору для знезараження збільшується в 2-4 рази.
У воді місцевих джерел водопостачання, згідно із запропонованими орієнтовним гігієнічним нормам, азоту амонійних солей допускається до 0,1 мг / л, азоту нітритів - до 0,002 мг / л. Якщо ці речовини мінерального або рослинного походження, то вони втрачають значення як показники забруднення і допускається більш висока їх вміст у воді.
Самостійний інтерес представляють нітрати, так як в високих концентраціях вони викликають метгемоглобінемію. За сучасної теорії нітрати в кишечнику людини відновлюються в нітрити під впливом мешкають в ньому бактерій. Всмоктування нітритів веде до утворення метгемоглобіну. Таким чином в основі захворювання лежить та чи інша ступінь кисневого голодування, симптоми якого проявляються в першу чергу у дітей, особливо грудного віку, які хворіють переважно при штучному вигодовуванні (розведення сухих молочних сумішей водою, що містить нітрати) або при вживанні цієї води для пиття. Діти старшого віку і дорослі менш схильні до цього захворювання, так як у них сильніше виражені компенсаторні механізми. Концентрація нітратів на рівні 45 мг / л (в перерахунку на NO 3) є безпечною і прийнята в якості ГДК у питній воді. Високі концентрації нітратів зустрічаються в основному в підземних водах, будучи наслідком постійного забруднення води (особливо ґрунтових вод), або мінерального походження в зв'язку з геохімічними особливостями водовмещающих порід. У воді відкритих водойм концентрація нітратів, як правило, не буває високою, так як вони споживаються водною рослинністю. Винятком можуть бути лише випадки масивного забруднення водойм стічними водами, що містять нітрати.
Нітрити, будучи нестійкими сполуками, не накопичуються в воді в токсичних концентраціях, тому не мають значення в якості метгемоглобінобразующімі речовини.
Однією з найважливіших причин карієсу зубів вважається недолік фтору в питній воді і як наслідок - недолік його в організмі. Спостерігається пряма залежність між вмістом фтору в питній воді і захворюваністю карієсом зубів. Фтор разом з кальцієм і фосфором забезпечує твердість і міцність кісток і зубів.
Дія фтору здійснюється гематогенним шляхом після всмоктування в шлунково-кишковому тракті. З одного боку фтор стимулює процеси мінералізації зуба, з іншого, відкладаючись у вигляді фторапатита, змінює структуру твердих тканин зуба, посилюючи їх резистентність до хімічних і біологічних каріесогенним факторів, що діють в порожнині рота.
У поверхневих вододжерела переважає концентрація фтор-іона до 0,5 мг / л, а вода цих вододжерел використовується для більшості середніх і великих міст. Оптимальною вважається концентрація фтору в питній воді від 0,7 до 1,2 мг / л. Низькі концентрації фтору збільшують захворюваність карієсом. Надлишок фтору (вище 1,5 мг / л) призводить до флюорозу, відбивається на репродуктивне здоров'я, особливо хлопчиків. Є достовірна залежність частоти хвороб органів дихання і високих концентрацій фтору.
При вмісті фтору нижче 0,5 мг / л питну водопровідну воду рекомендується фторувати, що знижує захворюваність карієсом зубів на 65-70%. Слід пам'ятати, що засвоєння фтору з води на 20% краще, ніж з продуктів, це вимагає обережного ставлення до фторування води. При здійсненні фторування води, вміст в ній фтору повинно бути в межах 70-80% від допустимих максимальних рівнів стосовно кожного кліматичного району. При надмірному вмісті фтору у воді повинно здійснюватися дефторування.
Крім типових для складу природних вод хімічних елементів і солей у питній воді можуть бути присутніми хімічні речовини і сполуки, що потрапляють у водойми з промисловими і сільськогосподарськими стоками, а також залишкові кількості речовин, що додаються в воду при її обробці на водоочисних спорудах. Для них встановлені ГДК, які представлені в СанПіН. Одним з таких елементів є залишковий активний хлор, який додається при знезараженні води. Для досягнення ефекту знезараження містять хлор препарати додають в кількостях, які через 30 хвилин контакту води з хлором (достатнього для знищення вегетативних форм мікроорганізмів) створять певний надлишок його у воді (залишкова кількість) в межах від 0,3 до 0,5 мг / л. Великі кількості додадуть воді неприємний запах, особливо при наявності в воді фенолів і освіту галогенізованих вуглеводнів, що мають канцерогенну дію.
| Статті по темі: | |
|
Плектрантус або кімнатна м'ята догляд в домашніх умовах розмноження види плектрантуса з фото
Плектрантус Шведський плющ Plectranthus плектрантус (Plectranthus) -... Коренева система цибулини
Цибуля ріпчаста (Allium cepa) - дворічна рослина зі слабкою кореневою ... Кермек: вирощування з насіння, посадка і догляд
Кермек унікальне декоративна рослина. Дрібні квіточки кермека після ... | |