Odaberite čitaoce
Popularna statistika
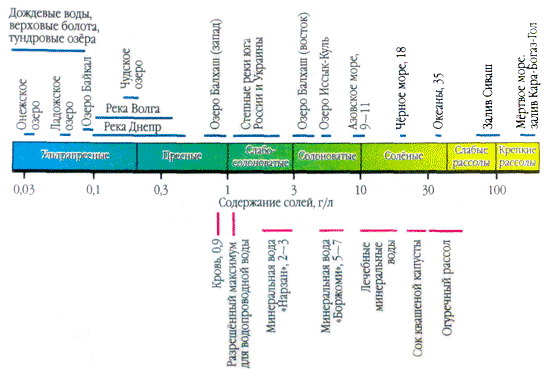
Nanesete li kapljicu prirodne vode na površinu i trljate je dok ne ispari, tada će se na mjestu kapi vidjeti bijelo odvajanje - a soli u vodi kristaliziraju. Prisustvo soli u prirodnim vodama povećava se hiljadama puta. Na primjer, litra kišnice sadrži jednu ili više desetina miligrama soli. A u litri vode iz uvala Kara-Bogaz-Gol (Kaspijsko more) - 300 g, možda trećina mase.
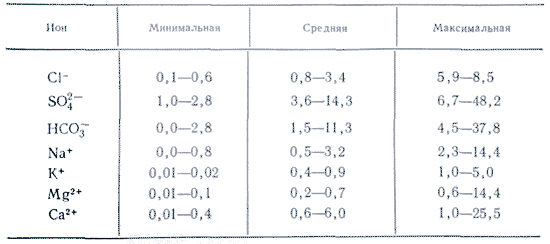
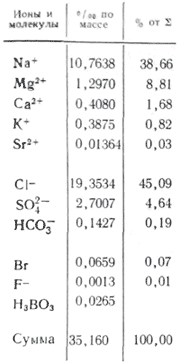
U primjenama u vodi, više soli je važno kao joni. U prirodnim vodama važna su tri anjona ( hidrokarbonat HCO 3 -, hlorid Cl -і sulfat SO 4 2-) i nekoliko katjona ( kalcijum Ca 2+, magnezijum Mg 2+, natrijum Na+і kalijum K+) - nazivaju se joni glave. Hloridni joni daju slan ukus vodi, sulfatni joni, joni kalcijuma i magnezijuma su gorki, hidrokarbonatni joni nisu slani. Mirisi u slatkim vodama su preko 90-95%, au visoko mineralizovanim vodama preko 99% svih rijeka. Donja granica koncentracije za glavne jone je 1 mg/l, pa se u nekim slučajevima, na primjer, za morske i neke podzemne vode, glavnim komponentama mogu dodati i Br - , B 3+, Sr 3+ itd. Dodatak K+ jona broju glava i leđa. U podzemnim i površinskim vodama ovi ioni po pravilu zauzimaju drugačiji položaj. Samo K+ joni u atmosferskim padavinama mogu igrati glavnu ulogu.
Proteionski oblik glavnih komponenti energije uvijek je koristan za niskomineralizirane vode. Kada se koncentracija između jona poveća, doći će do interakcija, direktne povezanosti. proces, obrnuta disocijacija. U ovom slučaju se stvaraju povezani parovi jona, na primjer MgHCO 3 + CaHCO 3 + .
Sa prilivom klimatskih i drugih umova, hemijsko skladištenje prirodnih voda se mijenja i proizvodi karakteristične obrasce, neke specifične za različite vrste prirodnih voda (atmosferske padavine, rijeke, jezera, podzemne vode).
Atmosferske padavine Sve prirodne vode su najmanje mineralizirane, ali iza kemijskog skladištenja njihovih tvari, smrad nije ništa manje raznolik od ostalih prirodnih voda. Jerelomovo skladište je aerosol atmosfere. Skladište ima više različitih tipova. Kada postoji prosečno bogata mineralizacija atmosferskih padavina u evropskom delu Rusije u rasponu od 10-20 mg/l i ekstremne vrednosti za celu teritoriju 3-4 i 50-60 mg/l jona Ovo skladište karakteriše strogošću, a srednji anjoni su najvažniji SO 4 2- ili HCO 3 - , a sredina katjona se drži na nivou udaljenosti da bi se sačuvao Ca 2+ ili Na +. Kako bi se izbjegao vjetar s mora, zbog vjetra mehaničkog uklanjanja soli povećava se koncentracija klora u otpadu. Kao rezultat očuvanja, koncentracija Cl - u vodi opada, a SO 4 2-, Ca 2+ i Mg 2+, međutim, raste. Razlog za kretanje umjesto SO 4 2- i Ca 2+ je obogaćivanje atmosfere aerosolima kontinentalnog kretanja. Kako se svijet pomiče dublje u kontinent, neki od morskih aerosola se ispiru. Najveće promjene pokazuje koncentracija SO 4 2-. Ako se dodaci Ca 2+ i Na + vežu mineralnom pilom tla i pora, na čijoj površini je uvijek prisutna sol, onda se na jednu stranu stavlja dodatak SO 4 2, oksidacija SO 2 i H 2 S, inače - porast kiselih soli sa slanih površina.
Nemoguće je dobiti približnu procjenu velikog broja čestica soli koje se dižu iz tla, slanih jezera, na površini leda, gnojidbe i listopadnih tvari koje se oslobađaju kao kemijske i metalurške tvari, a ispuštaju se u atmosferu kao rezultat drugih ljudskih aktivnosti, a zatim ih isperu padavine.
Voda veći dio rijeke spadaju u klasu hidrokarbonata. Iza skladištenja katjona, ova voda može sadržavati i kalcijum; Hidrokarbonatne vode s visokom koncentracijom magnezija i natrijuma su čak rijetke. Prirodne vode klase hidrokarbonata imaju najveću količinu vode sa niskom mineralizacijom (ukupni sadržaj soli do 200 mg/l).
Gotovo je bezbroj rijeka s vodom koja dostiže klasu sulfata. Smrad je širi, posebno u stepskim smoothiejima i često u praznim. U skladištenju kationa u prirodnim vodama klase sulfata, kao iu vodama hidrokarbonatne klase, prevladava kalcij. Međutim, brojne rijeke u klasi sulfata su pretrpane natrijumom. Po mineralizaciji vode sulfatne klase značajno je premašivanje vode hidrokarbonatne klase. Rečne sulfatne vode sa niskom (sadržaj čvrste materije do 200 mg/l) i srednjom (sadržaj čvrste materije od 200 do 500 mg/l) mineralizacijom se retko povećavaju ravnomerno. Najkarakterističnije za ovu rijeku je niska (sadržaj soli od 500 do 1000 mg/l), visoka (sadržaj soli preko 1000 mg/l) mineralizacija vode.
Rijeke čije vode dostižu nivo hlorida su rijetke kao i rijeke čije vode sadrže sulfate. Ispred ove teritorije leže najvažnije stepske regije, ali uzalud. Najvažniji katjoni prirodnih voda su klase hlorida, uglavnom natrijuma. Vode hloridne klase imaju visoku mineralizaciju - preko 1000 mg/l, preko 500 do 1000 mg/l.
Karakteristike jonskog skladištenja riječne vode izvode se do ljetnog perioda. Sve do pevačkog sveta karakteriše magacin i za vreme ledenog pada. To znači da se izbjegava manja mineralizacija vode tokom proljetne sezone.
Postoji konzistentan obrazac u distribuciji jonskog skladištenja riječne vode u Rusiji. Opći trend povećane mineralizacije vode na širem području evropskog dijela Rusije iz dana u dan i od početka spuštanja. Zonalnost jonskog skladištenja riječnih voda objašnjava se djelovanjem klimatsko svjesnih umova sadašnjeg vremena i klimom prošlosti. Nivo vlažnosti tla i stijena, prisutnost lako isparljivih soli u njima i salinitet tla prirodni je rezultat bogatog priliva različitih klimatskih umova. Uništiti zonalnost hemijskog skladišta vode rijeke Rusije i važnost skladišta vrsta i umova njihove kontaminacije.

Mineralizacija i hemijsko skladištenje jezerske vode Promjena od rijeke do rijeke mijenja se na vrlo širokim granicama. Rijeke sa mineralizacijom vode iznad 100-200 mg/l, iz nekog razloga je bilo smrada, rijetka su pojava, dok je mineralizacija jezerske vode čak niska, nekoliko desetina mg/l (sasvim mali porast od daske) do vrlo visoka 3 -3,5% (slana jezera sa ružinom slanom vodom do ruba natopljena solima). Na sadržaj mineralizacije utiče skladištenje jona u jezerskoj vodi. Niko nije svjestan zakona, snage i hemijskog skladištenja riječne vode. Sa povećanom mineralizacijom jezerske vode dolazi do naglog povećanja jona u njenom skladištenju u sledećem redosledu: HCO 3 - →SO 4 2- →Cl -; Ca 2+ →Mg 2+ →Na + . Kada mineralizacija u jezerskoj vodi dostigne 500-1000 mg/l, prevladavaju hidrokarbonatni joni, iznad 0,1% - najčešće sulfatni, a nakon dostizanja 0,3-0,5%, u zavisnosti od litoloških karakteristika vode.slatka voda - sulfatna ili hloridna voda . U skladištenju katjona u jezerskim vodama važna je uloga kalcijuma, štedi se manje od 0,1-0,2%. Kako se mineralizacija dalje povećava, natrijum počinje igrati ovu ulogu. Zadržavaju magnezijum, kao i sve druge vode, u srednjem položaju tokom svih mineralizacija. Razlog za ovu podjelu jonskog sastava leži u različitim vrstama soli. Najvažniji dio slatkih jezera, kao što su rijeke, iza akumulira hidrokarbonatno-kalcijumske vode.
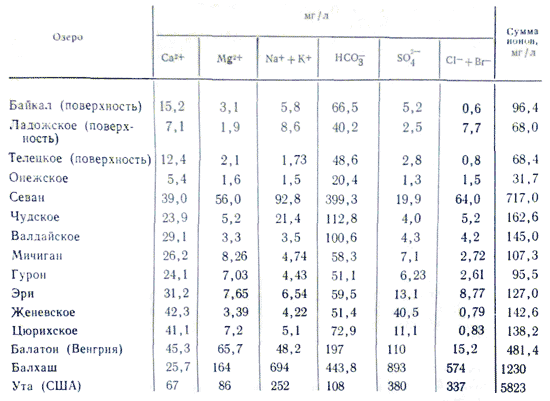
dionica morska voda karakteriše velika količina soli. U kontinentalnim vodama najčešće se primjećuju sljedeći omjeri koncentracija: HCO 3 - > SO 4 2- > Cl - i Ca 2+ > Mg 2+ > Na + ili Ca 2+ > Na + > Mg 2+, zatim za bočatu i morske vode, počevši od halal mineralizacije od 1 g/kg, odnos se mijenja: Cl - > SO 4 2- > HCO 3 - i Na + > Mg 2+ > Ca 2+. Promjena odnosa voda iz riječnih prema morskim vodama objašnjava se nedavnim napretkom u pogledu važnosti soli niskog kvaliteta u svijetu povećane mineralizacije vode. Ukupno, oni i polovina glavnih komponenti čine 99,99% svih komponenti u okeanskoj vodi i mineralnim tokovima.
Između elemenata glavnog skladišta soli oceanske vode, između kože i njihove sume, nalazi se praktični čelik u odnosu na koncentraciju. Preostali yogo dov U. Ditmar, vykonav nove hemijske analize (hloridi, sulfati, kalcijum, magnezijum, natrijum) 77 uzoraka vode dostavljenih iz svih okeana sa različitih dubina ekspedicije na "Challengeru": u vodi na otvorenom okeanu bez obzira na apsolutna koncentracija ugljičnog dioksida između glavnih komponenti glavnog skladišta soli je uvijek konstantna (Dittmarov zakon). PID s Viparovvannya Vyparovvannya, tupost, tupa tannna lodiv sabbaths vaške soli, taban bijelog sljeza, ale -ahled u Morskiye, inozemstvo u interglovima nije za prostranstvo prostranstva da se ne zmije. Takav rang, yakshcho vídomo, je vrijeme azotnih soli Kilkosti I koncentrata, osnovne komponente 1 kg vode prije koncentrata istog Ingredi, lišajeva za jedno od bogosluženja može izračunati skladište spasa u oceansko drive. U kontekstu takvog „referentnog“ sastojka postoji „hloritet“, koji predstavlja nekoliko grama jona hlora, što je ekvivalentno količini halogena (uključujući fluoride, koji se ne talože nitratima) koji su prisutni u 1 kg morske vode. (dodijeljeno Sorensenu). Stabilnost akumulacije okeanske vode lako se narušava prilivom kontinentalnog oticaja, koji se osvježava, u estuarskim područjima i u blizini unutrašnjih mora sa otežanom razmjenom vode sa okeanom. U skladištu glavnih komponenti, koncentracija kationa kalcijuma i magnezijuma, kao i zbir koncentracije anjona slabe kiseline (HCO 3 -, CO 3 2-, H 2 BO 3 -) značajno su niži za 1% u stabilizaciji sp Dodan u vezu sa derivatizovanim karbonatnim kalcijumom iz vode u površinskim kuglicama i razgradnjom vode na glini.
Koncentracija mikroelemenata u tableti je mala, tako da količina smrada prelazi 0,01% masenog udjela svih otopljenih soli. Iz alarma sa zadnje strane V.V. Gordeva i A.P. Prati se lizicin, u kojem najveće koncentracije uključuju litijum (180 µg/l), rubidijum (120 µg/l), barijum (18 µg/l), najmanje - zlato (0,004 µg/l), retke zemlje (manje). od 0,001 µg k) radijuma (10 -7 µg/l).
Što je more više izolovano od okeana, skladištenje njegove vode se više razlikuje od skladištenja vode u okeanu. Od primarnog značaja su razmena vode sa okeanom, odnos između zapremine kontinentalnog oticanja i zapremine mora, dubine mora i prirode hemijskog skladištenja vode u reci koja se uliva u njega.
Podzemne vode Uznemiravaju ih ljubičaste boje hemijskog skladišta i jonskog skladišta. Akumulacija vode dolazi u svim klasama i grupama tipova. Prvo skladište podzemnih voda je prvo koje se skladišti u svijesti njihovog nastanka i kontaminacije.
Prirodna voda ima tendenciju da održava pH vrijednost manje stabilnom, jer snažno smanjuje kiselost kiseline ili baze. Ako u litar destilovane vode dodate kap koncentrovane hlorovodonične kiseline, pH će pasti sa 7 na 4. Ako dodate kap hlorovodonične kiseline u litru rečne vode sa pH = 7, pH vrednost se može promeniti. Kiseline i baze koje troše prirodnu vodu neutraliziraju se ugljičnim dioksidom i ionima hidrokarbonata otopljenim u njoj:
H + + HCO 3 - ↔ H 2 O + CO 2
OH - + CO 2 ↔ HCO 3 -
Hidrokarbonatni joni neutraliziraju kiseline koje se gube u vodi atmosferskim taloženjem ili nastaju kao rezultat vitalnosti organizama. Otpornost na vodu i kisele kiseline direktno je povezana sa koncentracijom hidrokarbonatnih jona. Najosjetljivije rijeke na njih su jezera Karelije, Finske, Skandinavije, u njihovim vodama praktički nema takvih jona.
Organska rijeka prirodnih voda je kompleks istinski dezintegriranih i dobro formiranih rijeka organskih akumulacija. U zavisnosti od situacije, organske rijeke prirodnih voda mogu se podijeliti na one koje teku iz područja drenaže i nastaju u blizini vodnog tijela. Do prve grupe dolazi glavni dio humusnih mješavina, koje se ispiru vodom iz tla, treseta, šumskog humusa i drugih vrsta prirodnih otopina, koje uključuju viškove biljaka, te organske tvari koje dolaze iz industrije i države. otpadne vode. Među hidrohemijskim huminskim kiselinama najveći su interes huminske i fulvo kiseline. Uvredljive kiseline su karakteristične za humus (huminska kiselina), smrad ne postoji u živim biljnim i životinjskim tkivima. Odnos između njih u različitim tresetima i tlima je različit. U crnim zemljištima važnije su huminske kiseline, a u podzolatnim fulvo kiselinama.
Koncentracija organske materije u prirodnim vodama, koja varira u širokim intervalima, najveća je u močvarnim vodama (koje uz visoku koncentraciju humusne materije ponekad dostižu 500 mg/l ili više) i rekama sa močvarnim konobama, a močvarna voda je okaljan od strane smeđe boje do 300° i iznad platinasto-kobaltne skale vrijednosti boje (dodatkom prirodne vode dodaju se huminske kiseline). Visoka koncentracija organske govorne inode je koncentrisana u podzemne vode Još veće koncentracije se mogu javiti u prirodnim vodama kontaminiranim industrijskim i kućnim otpadnim vodama. Nezagađene prirodne vode uzrokuju malo protoka organske tvari. Na primjer, za B.A. Skopintsev, u okeanskoj vodi koncentracija organske materije postaje manja od 2,0-5,4 mg/l (u prosjeku 3,0 mg/l, au riječnoj vodi u prosjeku 20 mg/l).
U nekim površinskim vodama, posebno u rijekama iz močvara, humusne naslage čine glavni dio hemijskog sastava vode. Kada se reke, a potom i jezera i mora dobro prozrače, organski delovi vode su podložni promenama, a u zemljištu se proces oksidacije najvećim delom završava prelaskom iz jednostavne mineralne materije. Drugi, postojani dio se gubi i akumulira u vodnim tijelima.
U hladnim klimatskim zonama (tundra) ima vrlo malo organskih viškova, a tamo rezervoari vode možda ne sadrže huminske kiseline. A u zoni šuma, posebno četinara, gdje su organski ostaci u izobilju, a smrad se ne rastvara na površini, umjesto huminskih kiselina ima nekoliko desetina miligrama po litri. Huminske kiseline ne samo da zakiseljuju vodu u rezervoaru, već i vezuju gotovo sve važne metale u kompleksu.
Kada sipate hladnu vodu iz česme u flašu i stavite je na toplo mesto, na zidovima će se pojaviti mehurići gasa. Gazi je uništen u hladnom vodom i bili su vidljivi pri zagrijavanju (koncentracija plinova se mijenja pri zagrijavanju). Ovo je kiseli gas, dušik i ugljični dioksid. Intenzitet plina u vodi ima tendenciju smanjenja s porastom temperature, što je povezano s povećanjem kinetičke energije molekula plina, što smanjuje gravitacijske sile molekula vode. Sve prirodne vode predstavljaju izvore gasa. Kiseonika O 2 i ugljen-dioksida CO 2 ima najviše u površinskim vodama, a kiseonika H 2 S i metana CH 4 ima najviše u podzemnim vodama. U značajnim količinama, CO 2 takođe može biti prisutan u vodi iz dubokih horizonata. Osim toga, sve prirodne vode stalno sadrže dušik N2.
kisen (O 2) nalazi u prirodnoj vodi u izgledu slomljenih molekula. Kisen, kao jako oksidaciono sredstvo, igra posebnu ulogu u formiranju hemijskog skladištenja prirodnih voda. Kisen dolazi iz vode kao rezultat procesa fotosinteze koji se dešavaju u prirodi i iz atmosfere. Kisen se koristi za oksidaciju organskih materija, kao i u procesu degeneracije organizama. Koncentracija rastvorenog kiselog u prirodnim vodama varira između 0 i 14 mg/l, uz intenzivnu fotosintezu, pri čemu su potonje moguće i veće koncentracije. Zbog dugotrajne koncentracije kiseline u površinskim vodama zbog niskih faktora, njena koncentracija se značajno mijenja s trajanjem proizvodnje, godišnjim dobima i sudbinom. Malo je vjerovatno da će ostaci mrtve kiselosti ostati za sobom zbog promjena sunčevog zračenja, a fotosinteza u potpunosti ovisi o tome; kako dan napreduje, kiselost se akumulira, a tamni sat dozvoljava da se konzumira. Kiselo je neophodno za uništavanje većine organizama koji naseljavaju vode. Kao jaka oksidirajuća kiselina, ima važnu sanitarnu i higijensku ulogu, podržavajući brzu mineralizaciju organskih viškova.
ugljični dioksid (CO2) biti zadužen za vodu kako bi vidio razlaganje molekula u plin CO2. Međutim, dio (oko 1%) stupa u interakciju s vodom, otapajući ugljičnu kiselinu:
CO 2 + H 2 O ↔ H 2 CO 3
Pazite da ne dodajete CO 2 i H 2 CO 3 i ugljični dioksid u najvećoj mjeri (CO 2 + H 2 CO 3). U prirodnim vodama ugljični dioksid je prisutan prije procesa oksidacije organskih tvari, što je uzrokovano prisustvom CO 2 kako u vodi, tako iu tlu i površinama po kojima voda teče. Pred njima se čuje dah vodenih organizama i različiti pogledi biohemijska razgradnja i oksidacija organskih viškova. U pojedinim podzemnim vodama postoji važan izvor ugljičnog dioksida i vulkanskih plinova koji se mogu vidjeti iznad tla, čija je pojava povezana sa otplinjavanjem plašta i složenim procesima metamorfoze sedimentnih pora koji se tamo javljaju u glina ispod dotoka visoke temperature. Stoga se visoke razine ugljičnog dioksida često izbjegavaju u podzemnim vodama i glinovitim rezervoarima. Oslobađanje ugljičnog dioksida iz atmosfere vodom važnije je za vode mora i oceana, a manje za kopnene vode. Zamjena ugljičnog dioksida ugljičnim dioksidom nastaje tokom fotosinteze. Čak i uz intenzivnu fotosintezu, ako dođe do smanjenja plinovitog CO 2, preostali ioni se mogu vidjeti iz HCO 3 - jona:
HCO 3 - ↔ CO 3 2- + CO 2
Ugljični dioksid se također koristi za razgradnju karbonata:
CaCO 3 + CO 2 + H 2 O ↔ Ca(HCO 3) 2
Koristi se i hemijska vitrifikacija aluminosilikata. Promjena CO 2 u vodi, posebno u površinskim vodama na kopnu, također se opaža kada se ispusti u atmosferu. Goruća atmosfera CO 2 je od velike važnosti za CO 2 koji se nalazi u površinskim vodama i tamo ga reguliše. Između atmosfere CO 2 i površinskih voda CO 2 postoji stalna izmjena koja usmjerava uspostavljanje jednake ravnoteže između njih, na osnovu Henry-Daltonovog zakona. Parcijalni pritisak ugljičnog dioksida u atmosferi je vrlo mali (33 Pa), tada je, bez obzira na njegovu veliku čvrstoću (pri pritisku od 1013 hPa i temperaturi od 12 °C do 2166 mg/l), ravnoteža između vode i atmosfere dolazi sa vrlo malo mu sa CO 2 u vodi. Pri parcijalnom pritisku CO 2 u atmosferi od 33 Pa, njegova koncentracija u vodi će biti 2166,0,00033 = 0,715 mg/l (na 12 °C). Zbog površinskih voda kopna, u kojima se odvijaju različiti procesi razgradnje organske tvari i tla, provodi se veća količina CO 2 te se stoga ispušta u atmosferu. Osim ako fotosinteza nije jako jaka, ako je prisutan CO 2, CO 2 se može ukloniti iz atmosfere. Umjesto ugljičnog dioksida u prirodnim vodama, on je izuzetno varijabilan - i do nekoliko desetina puta do 3000-4000 mg/l. Najniža koncentracija CO 2 uočena je u površinskim vodama, posebno mineralizovanim (more, slana jezera), a najveća u podzemnim i zagađenim otpadnim vodama. U rijekama i jezerima koncentracija CO 2 rijetko prelazi 20-30 mg/l.
Rozchinny molecular dušik (N 2)- Najstabilniji gas u prirodnim vodama. Hemijski najstabilniji i biološki najvažniji dušik, unošenjem u glinene kugle u oceanu ili podzemnoj vodi, brzo se mijenja samo pod uticajem fizičkih sila (temperature i pritiska). U slučaju površinskih voda, dušik igra važnu ulogu u vodosnabdijevanju. U prirodi je široko rasprostranjeno povećanje biogenog dušika, što je rezultat denitrifikacije.
Gas metan (CH4) dostižu najveće gasove i podzemne vode. U plinovitoj fazi podzemnih voda često prevladavaju dušik, ugljični dioksid ili metan. Glavni izvor stvaranja metana su dispergirana organska jedinjenja u stijenama. Metan, koji je važan u ugljikohidratima, često se javlja u značajnim koncentracijama u dubokim podzemnim vodama zatvorenih struktura povezanih sa naslagama nafte. U niskim koncentracijama, metan se akumulira u prirodnim jezerima, gdje se može vidjeti sa mazge kada se postavljaju visoka stabla, kao i u naslagama na dnu oceana u područjima visoke biološke produktivnosti.
Gas Sirkovoden (H 2 S) To je jedan od proizvoda razgradnje proteinske materije koja se skladišti u Vašem magacinu, pa se njeno nakupljanje često skladišti u donje kuglice sa vodom zbog truljenja raznih organskih viškova. U nižim dijelovima dubokih jezera i mora, gdje postoji dnevna razmjena vode, često se razvija dubokovodna zona. Sa parcijalnim pritiskom vode u atmosferi ispod nule, prisustvo vode u površinskim vodama je nemoguće. Osim toga, vino se oksidira kiselinom, koja se otapa vodom. U rijekama je duboka voda uglavnom ograničena na pridnene bazene, posebno u zimskom periodu, kada je aeracija vodnog tijela otežana. Prisustvo vodene vode u prirodnim, nezagađenim površinskim vodama je rijedak fenomen. Mnogo češće nego ne, voda je prisutna u podzemnim vodama izolovanim od površinskih i u visoko zagađenim površinskim vodama, u kojima vina služe kao pokazatelj teške kontaminacije i anaerobne drenaže.
Pored onih u vodi, u koncentracijama od 0,1 do 10 mg/l prisutan je i niz elemenata: azot, fosfor, silicijum, aluminijum, pljuvačka, fluor. Smrad se naziva mezoelementima (od grčkog "Mesos" - "srednji", "srednji").
Azot u obliku nitrata NO 3 - gubi se u vodi i stolnoj vodi, a u obliku aminokiselina, soli (NH 2) 2 CO i amonijum soli NH 4 + - pri odlaganju organskih viškova.
Fosfor je prisutan u vodi u obliku hidrofosfata HPO 3 2- i dihidrogen fosfata H 2 PO 3 - nastalih kao rezultat razgradnje organskih viškova.
Silicijum je bitna komponenta hemijskog skladištenja prirodnih voda. To je zbog prisutnosti drugih komponenti posvuda u prisustvu silicijuma u planinskim stijenama, a mala raznolikost preostalih komponenti objašnjava minimalni sadržaj silicija u vodi za piće. Koncentracija silicija u prirodnim vodama je nekoliko miligrama po 1 litri. U podzemnim vodama raste i često pada na desetine miligrama po 1 litru, au vrućim termalnim vodama - do stotine. Osim temperature, na osjetljivost silicija snažno utječu i pH pomaci. U površinskim vodama postoji mala količina silicija, koji se reducira u silicijum dioksid (125 mg/l na 26 °C, 170 mg/l na 38 °C), što ukazuje na prisustvo procesa u vodi koji mijenjaju njenu koncentraciju. Prije njih, potrebno je uvesti vodene organizme bogate silicijumom, od kojih će mnogi, na primjer, dijatomejske alge, činiti njihov silicijumski kostur. Osim toga, silicijska kiselina, kao slaba kiselina, razlikuje se od ugljične kiseline:
Na 4 SiO 4 + 4CO 2 + 4H 2 O = H 4 SiO 4 + 4NaHCO 3
Smanjuje nestabilnost silicijuma zbog sklonosti silicijumske kiseline da se pretvori u gel. U vrlo malo mineralizovanih voda, silicijum postaje izvor, a ponekad i važan deo hemijskog sastava vode, bez obzira na sve. Prisustvo silicijuma u vodi predstavlja ozbiljan nedostatak u tehnologiji, jer kada je ključala voda potpuno suha, silicijum stvara vrlo tvrdu silikatni kamenac u kotlovima.
Aluminijum je prisutan u blizini vode zbog prisustva kiselina na glini (kaolin):
Al 2 (OH) 4 + 6H + = 2SiO 2 + 5H 2 O + 2Al 3+
Glavni depozit je glina. Organski ostaci (u daljnjem tekstu “C”), kada su u kontaktu s njima, smanjuju sadržaj na dvovalentni, koji se potpuno apsorbira u obliku hidrokarbonata ili soli huminskih kiselina:
2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 = 4Fe(HCO 3) 2
Kada voda sa otopljenim ionima Fe 2+ dođe u kontakt s vodom, ona brzo oksidira, stvarajući smeđi talog Fe(OH) 3 hidroksida. Ove godine se pretvara u močvarnu rudu - smeđi korov (limonit) FeO(OH). Karelska močvarna ruda vađena je u 18.-19. vijeku da bi se izvukla obloga.
Plava pljuvačka na površini vode je Fe(OH) 3, koja se rastvara kada podzemna voda koja sadrži ione Fe 2+ dođe u kontakt sa površinom. Često se gube u topljenju polietilena, ali ih je vrlo lako razdvojiti: talina hidroksida će zacijeliti poderane rubove. Kada tečnost bude na površini vode, istisnite rastopljeni hidroksid u posudu za ulje, kako ne bi prelio.
U ovu grupu spadaju elementi koji se u prirodnim vodama nalaze u vrlo malim koncentracijama, pa se nazivaju mikroelementi. Njihova koncentracija varira u mikrogramima po 1 litri (mcg/l), a često ima i veće vrijednosti. Mikroelementi su najveća grupa elemenata u hemijskom sastavu prirodnih voda, obuhvataju sve elemente periodnog sistema koji nisu obuhvaćeni prethodnim grupama komponenti koje su razmatrane. Mentalno se mogu podijeliti u pet podgrupa: 1) tipični katjoni (Li+, Rb+, Cs+, Be 2+, Sr 2+, Ba 2+ i tako dalje); 2) joni važnih metala (Cu 2+, Ag +, Au +, Pb 2+, Fe 2+, Ni 2+, Co 2+ i dr.); 3) amfoterni kompleksi (Cr, Mo, V, Mn); 4) tipični anjoni (Br -, I -, F -); 5) radioaktivni elementi. Mikroelementi su neophodni za normalan život biljaka, životinja i ljudi. Međutim, s povećanom koncentracijom, mnogi mikroelementi su štetni i štetni za žive organizme. Zbog toga se smrad često topi u blatne zvukove i njihova koncentracija se kontroliše. Uspješan uzgoj mikroelemenata je otežan zbog njihovog malog prisustva u prirodnim vodama, te zbog velike nesigurnosti oblika njihovog prisustva u vodama. I dalje je teško objasniti obrasce njihove migracije i režim, i stvara poteškoće u hemijskoj analizi. Na primjer, puno važnih metala Migriraju u visokim koncentracijama u vitalno, a ne u neuređeno stanje. Dezintegrisani organski kompleksi stvaraju većinu metala, pre svega trovalentne metale sa huminskim i fulvo kiselinama. Koncentracija kompleksiranih metala izračunava se prije koncentracije organskih kiselina. Izgled stijena je bogat metalnim hidroksidima. Moguće je da dođe do adsorpcije organskih tvari na površini koloida, što im daje veću stabilnost u razgradnji.
Hemijsko skladište prirodna voda znači prethodnu istoriju, dakle. staze koje voda formira u procesu svog kruženja. Niz različitih govora u takvoj vodi deponuje se, s jedne strane, iz skladišta ovih govora kojima je tekla, s druge - iz umova s kojima su međusobno komunicirali. Sljedeći faktori mogu dodati vodu hemijskom rezervoaru: planinske stijene, tla, živi organizmi, ljudska aktivnost, klima, reljef, vodni režim, vegetacija, hidrogeološki i hidrodinamički uslovi itd. Pogledajmo bliže faktore koji ulaze u skladište vode.
Propadanje tla i atmosferske padavine, koji se filtriraju kroz tlo, rezultiraju razgradnjom stijena i minerala. Ovo je jedan od najvažnijih uticaja na tlo koje se uliva u kalupno skladište prirodnih voda, što rezultira povećanom koncentracijom ugljičnog dioksida u tlu, što se vidi pri isušivanju živih organizama i korijenskog sistema u zemljištu i biohemijskom razgradnji. organskih viškova. Kao rezultat toga, koncentracija CO 2 u zemljišnom zraku raste sa 0,033%, u atmosferskom zraku, na 1% ili više u zemljišnom zraku (u važnim glinovitim zemljištima koncentracija CO 2 u zemljišnom zraku Vjetar dostiže 5 -10%, čime se pasmina daje snažno agresivno djelovanje prema starosti). Drugi faktor koji pojačava agresivno djelovanje vode koja se filtrira kroz tlo je organska tvar – humus zemljišta, koji se uspostavlja u tlu tokom transformacije viška vegetacije. U skladištenju humusa u posudi aktivnih reagensa prvo moramo navesti huminske i fulvo kiseline i jednostavne supstance, kao što su organske kiseline (limunska, kisela, okstoična, jabučna itd.). Eksploatacija tla, bogata organskim kiselinama i CO 2, često se ubrzava hemijskom vitrifikacijom aluminosilikata koji se nalaze u tlu. Slično, voda koja se filtrira kroz tlo ubrzava kemijske vibracije aluminosilikata i karbonatnih stijena koje leže ispod tla. Vapnyak lako otapa niskokvalitetni (do 1,6 g/l) kalcijum hidrokarbonat:
CaCO 3 + H 2 O + CO 2 ↔ Ca(HCO 3) 2
U celom evropskom delu Rusije (Krim Karelije i Murmanska oblast) ležišta, kao i dolomit MgCO 3 .CaCO 3, leže blizu površine. Stoga je ovdje važno da voda sadrži kalcijum i magnezijum hidrokarbonat. U rijekama kao što su Volga, Don, Južna Dvina i njihovi glavni pritoci, kalcijum i magnezijum hidrokarbonat postaju 3/4 do 9/10 svih otopljenih soli.
Soli se konzumiraju iz vodenih tijela i kao rezultat ljudske aktivnosti. Dakle, putevi se posipaju natrijum i kalcijum hloridima kako bi se led otopio. U proljeće, hloridi se slivaju iz otopljene vode u rijeci. Količine hlorida u rijekama evropskog dijela Rusije tamo su donijeli ljudi. U blizini rijeka na kojima se nalaze velika mjesta, ovaj dio je bogatiji.
Reljef lokaliteta indirektno ulijeva rezervoar vode, apsorbirajući uklanjanje soli iz tla. Dubina erozivnog usjeka rijeke olakšava dolazak do rijeke sa mineraliziranijim podzemnim vodama iz nižih horizonata. Ko može da primi druge tipove depresija (riječne doline, jaruge, jaruge), koje poboljšavaju drenažu sliva.
Klima stvara vruću pozadinu, koja omogućava da se odvija veći broj procesa u formiranju hemijskog rezervoara prirodnih voda. Klima prvenstveno zavisi od ravnoteže toplote i vode, koja određuje naslage tla i zapreminu protoka vode, a samim tim i razvodnjavanje ili koncentraciju prirodnih poremećaja i mogućnost uništenja rijeka ili njihovog pada pod opsadu.
Veoma je važno da se hemijsko skladište vode dovede u veliki tok i promeni život vodnog tela i njegov odnos tokom vremena. U periodu topljenja snijega, voda u rijekama, jezerima i akumulacijama ima manju mineralizaciju, u periodu kada većina života potiče iz podzemnih i podzemnih voda. Zbog toga se namještaj koristi za regulaciju površine vode i uklanjanje vode iz njih. Po pravilu, slivnici se nadopunjuju tokom proljetne sezone, ako plimna voda ima manju mineralizaciju.
Hemijsko skladištenje vode može biti različito, a fragmenti mogu ležati na mjestu čestica neorganskih i organskih tvari. Prolazeći kroz različite dijelove zemlje, voda razgrađuje soli (kalcijum, magnezij, itd.) prisutne u njima.
Rotirajući na površini zemlje, voda se akumulira s plinovima, rastvarajući ih. Prirodne vode su odvojene od hemijskog skladišta u jednoj vrsti, tako da se formiraju od gasova, bazičnih jona, biogenih i organskih materija i mikroelemenata.
Veliki dotok vode i hemikalija se primjenjuje na tlo i gredicu. Voda uklanja mineralne i organske tvari iz tla, koje se posebno pažljivo čuva u prvim fazama rada.
Gasni režim u prirodnim i vještačkim rezervoarima formira se kombinacijom gasova koji se gube iz atmosfere i kao rezultat hemijskih procesa. Zbog temperature, pritiska i prisustva soli u vodi ostaje veliki broj otopljenih gasova.
Ovi plinovi, a prije svega kiselost i ugljični dioksid, jednostavno su neophodni za život vodenih organizama. Što ih je više u blizini vode, to je bolje za ljude u bazenu. Međutim, visok sadržaj vode, metana i dušika smanjuje vitalnost živih bića.
Jedan od najvažnijih gasova koji su stalno prisutni u površinskim vodama je kiseli gas. Značajna je količina vode koja se može naći u hemijsko-biološkim vodama.
Glavne džerele se pune kiselom vodom
- atmosfera - pod rastućim vjetrom, stapa se s površinskim kuglicama vode;
- Fotosinteza mikroskopskih algi.
Na visokim temperaturama se mijenja kiselost vode, a na niskim se povećava.
Kiselost vode u prirodnim vodama je manja od 100%, jer zapremina ovog gasa ide u oksidaciju organskih materija. Kada dođe do masovnog razvoja algi (zimi) u velikim vodenim tijelima, kiselost može doseći 150-200%.
Ugljični dioksid (CO 2) prisutan je u velikim količinama u svim prirodnim vodama. U ovom slučaju, većina ugljičnog dioksida je prisutna u otopljenom stanju, a mala količina ugljičnog dioksida (do 1%) može stupiti u interakciju s vodom i stvoriti ugljičnu kiselinu.
Povećanje koncentracije ugljične kiseline u smjesi za optimalni nivo temelji se na koncentraciji organskih tvari. Posebno je važno regulirati proizvodnju kiselosti i ugljične kiseline.
Da bi se utvrdio hemijski sastav vode i priroda njegove promjene, moraju se provesti laboratorijska ispitivanja. Osnovne informacije o kiselosti vode mogu se dobiti pomoću posebnog uređaja koji se koristi za ispitivanje. je čist blok sa dva jarka i skalom boja.
U prisustvu ovih i drugih hemikalija, voda koja se testira razvija jasnu boju koja je u skladu sa skalom boja na skali. Ljestvica boje kože određena je nivoom kiselosti vode.
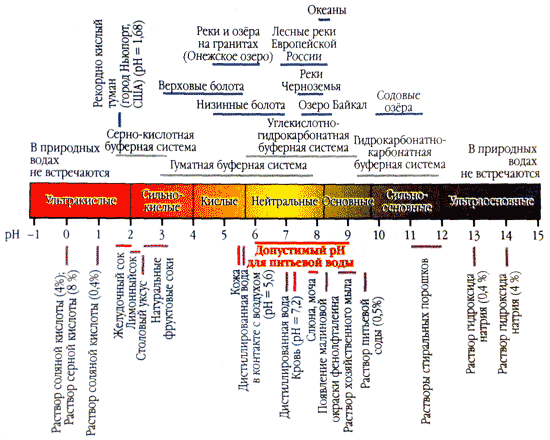
Kiselost vode (pH) karakterizira aktivnu reakciju medija. Što je pH vrijednost bliža nuli, veća je koncentracija vodenih jona u otopini, sredina je kiselija.
Optimalni pokazatelj kiselosti vode za čovjeka je u uskom rasponu od 7,2-7,4, a najviše 7,6. Sa tako jednakim pH, voda ne teče na ljudsku kožu i sprečava proliferaciju mikroorganizama.
Ako je pH vrijednost veća od 7,8, takva voda iritira kožu (posebno osjetljivu) i mikroorganizmi se mogu lako razmnožavati u vodi. Osim toga, visoka rabarbara pH podstiče korozivnu aktivnost vode, što značajno utiče na efikasnost posjedovanja i komunikacije.
Najviši nivoi pH vode (8-8,8) zapažaju se u drugoj polovini vegetacije, kada biomasa algi dostiže svoj najveći razvoj, a procesi fotosinteze se odvijaju maksimalnim intenzitetom.
Kao rezultat hemijskih reakcija poput vode. Nivo pH se postepeno menja, kako sa vodom tako i sa uzimanom vodom.
Oštrost vode u velikoj meri utiče na pH nivo. Da, da mekana voda pH rabarbare je manji od 7,0, a gorke može dostići 9,0.
Tvrdoća vode se određuje umjesto Ca CO2 (). Kada dođe do promjena temperature, talog pada na zidove bazena, filtere, izmjenjivače topline i drugu opremu.
Prema standardima, tvrdoća vode ne bi trebala prelaziti 30°dH, gdje je 1°dH = 10 mg CaO/l. Tvrdoća vode može da se promeni tokom dužeg stajanja. Tokom zime se dodatno smanjuje tokom kišne sezone.
Oksidacija vode određena je upotrebom raznih organskih i mineralnih tvari.
Količina oksidacije pokazuje koliko se oksidacija gubi na uništavanje organskih tvari (mg/l). Tokom tekuće vegetacijske sezone, oksidacija vode se mijenja od 10 do 30 mg na 1 litar ili više.
Skladište hemijske vode. U prirodi je uobičajeno da voda uvijek sadrži više ili manje svojih mineralnih soli. Korak skladište minerala Voda je određena prirodom tla ili tla koje leže do vodonosnika ili rezervoara površinske vode.
Količina mineralnih soli, poput vode, izražava se u mg/l.
Organski govori. Od njih su najvažnije riječi o putovanju stvorenja, fragmenti smrada mogu sadržavati razne patogene mikrobe. Indirektni higijenski pokazatelj prisutnosti ili prisutnosti ovih tvari u vodi je oksidacija vode.
Oksidacija vode. Količina kiselosti (mg) koja se troši na vanjsku oksidaciju organskih tvari koja se nalazi u 1 litri vode (označena kao mg/l). Što je manja količina kiselosti u vodi, to je manja količina kiselosti na površini oksidacije u 1 litru vode sa organskim jedinjenjima. Na primjer, oksidacija čiste podzemne vode nije veća od 2-4 mg/l, riječne vode nije veća od 7 mg/l.
Jedan od pokazatelja mogućeg prisustva organskih kiselina u vodi je količina kiselosti otopljene u njoj (mg). U čistim vodama oslobađalo se 3-6 mg/l kisele vode, au zagađenim vodama znatno manje, do potpunog izostanka.
Prisustvo amonijaka, azotnih soli i azotnih kiselina može se uočiti u prisustvu amonijaka, azotnih soli i azotnih kiselina. Amonijak je proizvod cob stages truljenje organskog otpada od kuvanja, a soli dušične i dušične kiseline su konačni produkti mineralizacije organskog otpada. Evidentno je da je voda dugo bila začepljena.
Prisustvo soli hlorovodonične i kisele kiseline u vodi ukazuje na moguću kontaminaciju vode izlučevinama životinja i ljudi (fekalna kontaminacija). Smatrajte da 1 litar čiste prirodne vode sadrži nešto više od 20-30 mg hlorida.
Tvrdoća vode. Indiciran je umjesto soli kalcija i magnezija. Podijelite vodu na male komade, jedan po komad. Vidi se prirodna tvrdoća vode - tvrdoća sive vode, specifična tvrdoća, koja se mijenja pri ključanju ili stajanju, a ne prelijevanje, koja se ne smanjuje nakon ključanja vode.
Povrće i meso se slabo kuvaju u tvrdoj vodi, jer se proteini koji se nalaze u njima spajaju sa kalcijumom i magnezijumom u neorganske supstance koje se ne apsorbuju u crevima čoveka.
Takva voda nije prikladna za higijenske postupke: sadrži prekomjernu količinu soli koja se prelijeva, a nepoželjni ostaci se talože na kosi i formiraju mittu.
Tvrdoća vode za piće može biti veća od 7 mg/l. Ova karakteristika se može izraziti u stepenima (1 mg/eq tvrdoće vode je jednak 2,8°). Tvrda voda je voda koja ima više od 20°, meka voda je ispod 10°.
Sipaju se soli. Voda koja se izliva nije jeftina, ali u prekobrojnim količinama daje gorak metalni ukus i žućkastu ili žućkasto-smeđu aromu, smanjujući bistrinu. Dozvoljeno je da voda za piće sadrži do 0,5 mg/l (u hladnim vodnim tijelima) i 1,0 mg/l (u podzemnim vodnim tijelima).
Fluor. Šta god da se nalazi u vodi za piće, značajno teče na zube. Povećanjem koncentracije dolazi do fluoroze (pojava tamnih mrlja na caklini zuba), što dovodi do njihovog daljeg propadanja, a ako nema dovoljno karijesa, karijes postaje sve češći. Voda ne sadrži više od 1,5 mg/l fluorida, optimalna kiselost je 0,7-1,0 mg/l. Ako se fluorid ne ukloni, vodu treba fluorirati pojedinačno i dodati natrijum fluorid.
Prirodna (kopnena) vodena tijela imaju prirodne procese samopročišćavanja, jer ih ljudi ne mogu savladati:
*Bez ultraljubičastog zračenja;
*Taloženje i odvajanje važnih čestica;
*Oksidacija organskih materija zbog sadržaja O2;
* Mineralizacija organskih viškova usled rasta bakterija.
Strana 1
Skladištenje riječne vode određeno je količinom i jačinom potoka koji se u njih ulijevaju iz zemlje i vjetra, kao i otpadnih voda iz industrijskih i komunalnih preduzeća.
Klasifikacija skladištenja riječne vode prikazana je na Sl. 3.24 je pojednostavljen i ne pokazuje se uvijek djelotvornim.
Kao što su pokazala opsežna istraživanja skladištenja riječne vode, regulacija ispuštanja vode iz akumulacionog rezervoara ne zahtijeva toliko značajnih promjena koliko se može izvršiti riječna voda. koristeći trenutne metode analiza.
Zbog sezonskih posebnosti, promjene u akumulaciji riječne vode moraju se obnoviti u vrijeme izrade projekta instalacije. Klasa važnih katjona za kožu podijeljena je u tri grupe: kalcijum, magnezijum i natrijum. Na svoj način, grupa kože je podijeljena na četiri vrste vode, koje se prepoznaju po nizu jona. Krema sadrži važne katjone, riječna voda sadrži jone K, NH4, Fe2, Mn2, Cu2, Zn2, Ni2, Fe3, Al3 i u manjim koncentracijama niz drugih jona.
Da bi se razumjela priroda promjene snage i toka riječne vode duž naftonosnih formacija, 1957. Bušači TatNIPInafta samostalno su izbušili pet injekcionih bušilica.
U blizini naselja A industrijska otpadna voda može dovesti do velikog priliva industrijskih otpadnih voda u skladište riječne vode.
Uz upute iz tabele. 3 slike pokazuju da skladištenje riječne vode varira preko širokih granica. Riječne vode koje teku kroz plodna područja pune su karbonata i bogate kalcijumom. Riječne vode koje teku kroz sušna područja (na primjer, u zapadnom dijelu Sjedinjenih Država) sadrže više sulfata, manje kalcija i, stoga, manje karbonata. Bilo bi pogrešno zanemariti količinu organske tečnosti koja se prenosi vodama, čiji se fragmenti pretvaraju u naftu.
Hemijsko skladištenje podzemnih voda na priobalnim vodozahvatima je, drugim riječima, skladište riječne vode, koja je na svoj način označena kao skladište atmosferskih padavina, ali i kao skladište snijega, oluje i podzemnog oticanja. U atmosferi se akumuliraju kišnica i snijeg velika količina kiselosti, ugljičnog dioksida, dušikovog oksida, amonijevih soli, a u zagađenom okolišu industrijskih područja, pod pojmom supstanci, dodaju se piljevina, bakterije, sirup, produkti sagorijevanja uglja, nafte i drugih tvari.
Kao rezultat, samo mala količina začepljene kanalizacione vode protiče u blizini rijeke, što rezultira iscrpljivanjem skladišta otpadnih riječnih voda, što eliminira mogućnost dalje likvidacije.
Smrad je koncentrisan u obliku minerala, na primjer, gipsa Ca8O4 - 2H2O, mirabilita Na28O4 - 10H2O, a također ulazi u skladište morske i riječne vode.
Vode gornjih rijeka (kao i jezera i vode) odlikuju se obiljem akumulacije, što je rezultat života biljaka i bića koja se nalaze u blizini vode, te glavni događaj proljetnih poplava i dasaka koje se spiraju sa vode. obala značajan broj čestica tla. Istovremeno, u blizini naseljenih područja, otpadne vode i otpad iz industrijskih preduzeća često se slijevaju u područje za skladištenje riječne vode.
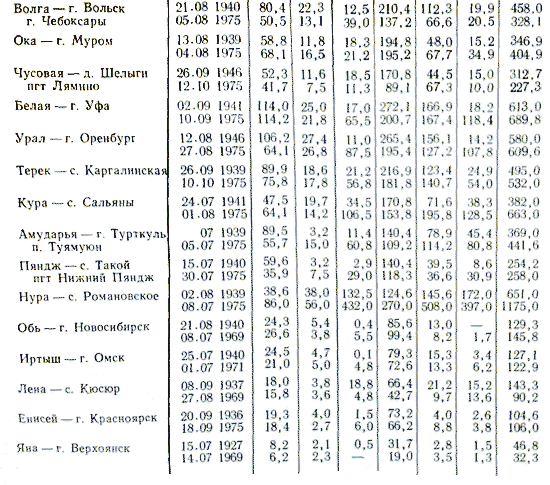
Hemijsko skladište u rijeci prepoznaje sezonske fluktuacije. Najveća mineralizacija riječne vode se javlja u periodu kada rijeka oživljava podzemnim vodama, a najmanja je zbog kišne sezone ili trajanja ledenih pokrivača. Skladištenje riječnih voda je u rukama fizičko-geografskih umova. U nadzemnim zonama mineralizacija vode je niska. Mineralizacija se također mijenja kako rijeka teče u utoku, vodozahvatu koji se nalazi u drugim kalupnim bazenima.
Skladištenje riječne vode, kao i otpada, čuva se do kraja vremena. Najmanje zamućenja i najveća mineralizacija javlja se tokom zime, dok se obrnuto dešava tokom poplava, posebno u proljeće. U trenutku sudbine, meteorološki odvodi, ljetni vjetrovi i drugi faktori se ulijevaju u skladište riječne vode.
Hemijsko skladište prirodnih voda je vrlo sklopivo. Imaju više porodice hemijski elementi, koji se računaju u delovima grama ili celim pa čak i desetinama ili stotinama grama po litru vode. To su elementi koji se nalaze u vodi i pojava iona ili molekula koji stvaraju složene strukture, uključujući i organske.
Stadij i prirodu mineralizacije vode na ovom i drugim lokalitetima narušava voda. Umjesto razgradnje neletećih mineralnih i dijelom organskih tvari u vodi, karakterizira se količina suhog viška (glavna količina, ukupno kloridi, sulfati, karbonati i bikarbonati, livadski i livadsko-zemljani metali). Vode koje sadrže veliku količinu mineralnih soli mogu dati neugodan slani ili gorko-slan ukus, pa je količina suvog viška vode za piće podložna sanitarnoj praksi zbog njenog priliva na slanu snagu vode na rijeci.čak i 1000 mg /l. Eksperimentalne studije su pokazale da je optimalna (organoleptička svojstva) hranljiva voda koja sadrži 200-400 mg soli po litri. Voda sa suvim viškom do 1000 mg/l naziva se svježom, a iznad 1000 mg/l mineraliziranom.
Promjene u primarnom nivou mineralizacije vode, koje nisu uzrokovane prirodnim razlozima (proljetne poplave), mogu se smatrati indikacijom kontaminacije vode rijekama trećih strana.
Hloridi u vodi su koncentrirani posebno u obliku natrijum hlorida i, najmanje, u obliku drugih jedinjenja (magnezijum hlorid, itd.). U prirodnim vodama kloridi se pojavljuju kao rezultat njihovog uklanjanja iz formacija tla. Područja sa slanom zemljom posebno su bogata hloridima. Hloridi su važni kao supstance koje menjaju ukus vode i utiču na fiziološke funkcije organizma. Počevši od koncentracije od 500 mg/l, hloridi izazivaju supresiju lučenja puževa, što se ogleda u promjeni kiselosti i jačine soka puževa koji truje. Kao rezultat toga, evakuacija života s broda će se ubrzati. U koncentraciji većoj od 1000 mg/l hlorid dovodi do promjene diureze, što može biti posebno štetno za osobe koje pate od srčanih bolesti i zdravstvenih problema. U koncentracijama iznad 350 mg/l hlorida, dodajte slanu vodu u smjesu.
Hloridi se mogu gubiti u vodi iz fekalija, reznica, kuhinjskog otpada, za komunalno vodosnabdijevanje, voda koja nije podložna kontaminaciji, hloridi mogu biti važni kao indirektni pokazatelj svakodnevne kontaminacije vode. Kod koga se ne procenjuje koncentracija hlorida, kolika je promena sata i dužine vode, onda. povećanje protiv vanrednih, prirodnih koncentracija. Jaka prisutnost hlorida i amonijaka u biljkama sa visokom oksidacijom i neugodnim bakteriološkim pokazateljima ukazuje na sanitarne probleme ove vode.
Sulfati u količinama većim od 500 mg/l, dodaju vodno-slan gutljaj u vodu, u koncentraciji od 1000-1500 mg/l, i najvjerovatnije potiskuju lučenje skutuma, djeluju laksativno na crijeva i dovode do negativan stav prema ukusima ljudi.poji njihove jake. Sulfati mogu biti pokazatelj kontaminacije površinskih voda životinjskim izlučevinama, budući da je skladišni dio proteinskih tijela sumpor, koji se, kada se razloži i dalje oksidira, pretvara u sol sumporne kiseline.
Tvrdoća vode pokazuje koncentraciju dvovalentnih katjona trava metala u njoj, prije svega kalcija i magnezija. Joni Ca(2+) i Mg(2+) mogu biti povezani sa različitim anjonima (HCO 3 , SO 4 , Cl , CO 3 , HNO 3 itd.).
Kalcijum i magnezijum hidrokarbonati Ca(HCO 3) 2, Mg(HCO 3) 2 i karbonati CaCO 3, MgCO 3 ukazuju na karbonatnu tvrdoću. Kada se voda zagrije, karbonatna smjesa se uništava (mijenja se u 2), zbog čega se hidrokarbonati pretvaraju u karbonate.
Razlika između kalcijumovih i magnezijevih karbonata znatno je manja nego kod hidrokarbonata, pa se s kipućom vodom smanjuje tvrdoća. Tvrdoća vode, sastavljena od hidrokarbonata kalcija i magnezija, naziva se karbonatna. Karbonatna tvrdoća se često kombinuje sa konvencionalnom tvrdoćom, ali ih je nemoguće izjednačiti jednu po jednu. Uz visoku koncentraciju magnezijum hidrokarbonata u vodi, razlika između karbonatne i konvencionalne tvrdoće može biti značajna. Vrijednost relativne tvrdoće praktično izbjegava sadržaj vlage u vodi, koja umjesto hidrokarbonata sadrži metale tla (Ca, Na, Mg, K) i druge soli slabih kiselina. Sadržaj vlage u vodi važan je za proces koagulacije vode tokom prečišćavanja. Razlika između zakonske i konvencionalne okrutnosti se zove stalna okrutnost, povezan je sa velikom količinom kalcijuma i magnezijuma, povezan sa drugim anjonima pored hidrokarbonata (Cl, SO 4, NO 3 i tako dalje).
Tvrdoća vode je jedan od bitnih kriterijuma za tvrdoću vode za piće. Tvrda voda nije prikladna za državne potrebe: povrće, meso i živina kuhaju se u tvrdoj vodi. spoljašnji izgled, slast i slatkoću čaja, loše je piti slatko, jer se natrijum u njemu u vodi zamenjuje kalcijumom i magnezijumom, usled čega se stvara talog sadržaja kalcijuma i magnezijuma. Tvrda voda može uzrokovati bolest i suhu kožu; U uređajima za grijanje u sistemima za opskrbu toplom vodom, tvrda voda stvara manji talog, što otežava njihov rad.
Što se tiče zdravlja, visoka gorčina se može smatrati jednim od faktora koji doprinose razvoju urolitijaze, kao što je već rečeno. U naredna tri sata razgovarat će se o ishrani kako bi se proždrljivost ulila u kardiovaskularni sistem; Postoje podaci o stopi smrtnosti od srčanih oboljenja zbog konzumiranja meke vode za piće. Ova hipoteza nije potvrđena u mnogim zemljama.
Ulazi u nevidljivi dio stvorenog organizma i služi za stimulaciju diholnih enzima (hemoglobin, katalaza itd.). Može se vidjeti kako napušta tijelo kroz crijeva. Tijelo zadovoljava svoje potrebe u prostoriji uglavnom živeći sa svojom okolinom, koliko je veliko da uđe u tijelo sa pije vodu, nema pravi fiziološki značaj. Oslobađanje Fe(2+), Fe(3+) događa se u svim prirodnim vodama u različitim koncentracijama. Pri visokim koncentracijama u vodnim tijelima, rezultat je sakupljanje otpadnih voda. Kada se voda distribuira kroz čelične (nepocinčane) cijevi, umjesto da uđe u nju, korozija se povećava. Toksičan efekat gutanja na organizam nije poznat. Kada su se davale oralno, veće doze (300 mg/kg ili više) su korištene za prevenciju gastroenteritisa bez znakova intoksikacije. Dakle, prisustvo vode u blizini vode nije posledica estetske i svakodnevne iritacije, pa vodi daje kalamutnost, pripremljenost i gorak metalni ukus. Osim toga, povećane koncentracije saliniteta u vodi potiču razvoj pljuvačnih bakterija; kada vodovodne cijevi izumru, nakuplja se teški sediment koji mijenja njihov promjer. Utvrđeno je da do povećanja bistrine i boje vode dolazi pri infuziji i kiselih i oksidnih tečnosti, a u svim slučajevima smrad je posledica prisustva hidroksida u tečnosti. Kada se koncentracija vode promijeni na 0,3 mg/l, bistrina i boja vode su jednake standardu. Metalni ukus vode javlja se u koncentraciji od 0,5 mg/l. Na osnovu metode eksperimentisanja sa populacijom, jasno je da sa znatno većim kapacitetom infuzije (preko 1,0 mg/l) voda može izazvati različite efekte na koži osobe, uključujući svrab i suvoću.
Da bi se boja vode dovela na traženi standard, u postrojenjima za prečišćavanje vode koriste se posebne metode za bojenje vode. Da bi se zamijenili sulfati, kloridi i druge soli u vodi, voda se desalinizira daljnjim dodavanjem različitih soli. Desalinizacija se provodi metodama destilacije, ionske izmjene i elektrodijalize. U svijesti lokalnog vodosnabdijevanja koristi se metoda zamrzavanja prirodnom hladnoćom i smrzavanja u komadima.
Za dezinfekciju vode koriste se sledeće metode: aeracija (oksidacija) i natapanje dalje ekstrahovanim hidroksidom iz tečnosti, koji je uklonjen, stajanjem i filtracijom: kao i vikoristička koagulacija vode i kationizacija.
Za omekšavanje vode (trajno ili djelomično uklanjanje vodenih katjona Ca(2+) i Mg(2+) koriste se reagensne metode koje se baziraju na tretmanu vode reagensima koji se kombinuju sa jonima kalcija i magnezija praktički nezamjenjivim tvarima koje potpadaju pod opsadu. (zbog čega je potrebno dodati gašenu paru u kombinaciji sa sodom). Praktičnije Takođe je usvojio metod jonske izmene za omekšavanje vode iz jonoizmenjivačkih smola. Omekšavanje vode metodom jonske izmjene može se obaviti korištenjem N-katjonskih kupki, H-katjonskih kupki, paralelnih ili naknadnih N-Na-katjonskih kupki.
U sanitarno-hemijskoj analizi vode važnu ulogu ima koncentracija soli amonijaka, dušične i dušične kiseline (nitriti i nitrati), što je indirektan pokazatelj zagađenosti vode organskim otpadnim proizvodima.
Organske tvari stvorene prirode koje se nalaze u vodi podliježu razgradnji, a do mineralizacije dolazi zbog prisustva mikroorganizama koji naseljavaju vodu. Ovaj proces se intenzivnije odvija u toplom vremenu i zbog prisustva kiseline u vodi. Mineralizacija organskih supstanci koje sadrže dušik odvija se u dvije faze. U prvoj fazi, koja se naziva amonifikacija, proteini i supstance se raspadaju na aminokiseline i soli. Do razgradnje proteina dolazi pod uticajem anaeroba (B.putrificus, B.sporogenes i drugi), fakultativnih anaeroba (B.micoides i drugi) i aeroba (B.mesentericus, B.subtilis i drugi). Amonifikacija sjemena uzrokovana je urobakterijama i mikrobima. Ostaci amonijaka su proizvod klipa, čije prisustvo govori o svježoj organskoj fermentiranoj vodi.
U drugoj fazi mineralizacije - nitrifikacije - amonijak i soli se oksidiraju u nitrite (uz pomoć B.nitrosomonas), a mirisi se oksidiraju u nitrate (uz pomoć B.nitrobaktera). Za rekonstituisanje amonijevih soli nitritom potrebno je potvrditi da je voda nedavno kontaminirana organskim tvarima. Nitrati su krajnji produkt mineralizacije organskih jedinjenja, a njihovo prisustvo je pokazatelj dugotrajne nečistoće vode.
Azotna jedinjenja nam omogućavaju da utvrdimo prisustvo kontaminacije vode, a biće i informacija o starosti kontaminacije. Dakle, ako se prisustvo amonijaka u vodi pri ponovljenim analizama više ne povećava, moguće je zaključiti da je voda kontaminirana i da se više ne kontaminira. Istovremeno sa amonijakom, u vodi se pojavljuju nitriti, što ukazuje da u posljednje vrijeme postoji sistematski zagađena voda. A ako u vodi ima amonijaka, nitrita i nitrata, onda to ukazuje na izuzetno nepovoljan rezervoar za vodu, što će reći o dugotrajnom i stalno zagađenom rezervoaru vode.
Ako voda svakodnevno pokazuje nitrate, amonijak i nitrate, to znači da su procesi mineralizacije organskih materija završeni, a samim tim i eliminisane nečistoće.
Međutim, treba napomenuti da kontaminacija vode tokovima organskog otpada nije jedini razlog za pojavu azotnih tokova u vodi. U čistim vodama koje leže duboko, kiselost se može javiti svakodnevno, pri čemu se stvaraju ispiranja kako bi se obnovili mineralni otpad nitrita i amonijaka. Ova vrsta povećanja koncentracije soli amonijaka i nitrita u dubokim interstratalnim vodama ne ukazuje na opstrukciju. Ostali znaci začepljenja vode će se pojaviti tokom dana.
Amonijumove soli, nitriti i nitrati u vodi natopljenoj vodom mogu biti produkti raspadanja, i proizvodi su razgradnje organskih materija taloženja u vodi. Supstance koje sadrže dušik mogu se gubiti iz vodosnabdijevanja kroz industrijske otpadne vode, kao i iz otpadnih voda sa područja koja su jasno oplođena supstancama koje sadrže dušik.
Dakle, za ispravnu higijensku procjenu prisustva azotnih spojeva u vodi potrebno je utvrditi razlog njihovog pojavljivanja u vodi. O nečistoći organske materije u vodi može se povoljnije govoriti o tome da se, paralelno sa mineralnim azotonosnim jedinjenjima u vodi, pojavljuju i drugi indikatori nečistoće: hemijski (visoka oksidacija) i mikrobiološki (niska količina, visoka količina). U voda iz česme, koje mogu biti nezagađene, amonijeve soli i nitriti kao indirektni pokazatelji epidemioloških problema u vodi gube na značaju. Prote, u vodi iz slavine koja nije kontaminirana hlorom, umjesto soli amonijuma, koncentracija ne smije prelaziti 0,5 mg/l, jer dodatkom manjeg broja aktivnih supstanci - hloramina, hlor vitrat za infekciju se povećava za 2-4 puta.
U lokalnim vodoopskrbama, zbog utvrđenih higijenskih standarda, amonijeva sol azota je dozvoljena do 0,1 mg/l, azota nitrita - do 0,002 mg/l. Kao rezultat aktivnosti minerala ili algi, značajni su kao indikatori opstrukcije i dopušteni su za upotrebu umjesto vode.
Od nezavisnog interesa je gubitak nitrata, koji izazivaju methemoglobinemiju pri visokim koncentracijama smrada. Prema dosadašnjoj teoriji nitrata u crijevima, ljudi nastavljaju nitriranje pod prilivom bakterija koje oklijevaju u novoj. Vlaženje nitrita se vrši dok se methemoglobin ne stabilizuje. Dakle, bolest se zasniva na istoj fazi kiselog izgladnjivanja čiji se simptomi najpre manifestuju kod dece, posebno u grudima, što je važno u slučaju individualne pripreme (razblažiti suve mlečne mešavine sa vodom za mešanje potrošiti) ili kada se konzumira, cijena vode za pitya. Starija djeca i odrasli su manje podložni bolestima, jer imaju jaču ekspresiju kompenzacijskih mehanizama. Koncentracija nitrata je jednaka 45 mg/l (kada se pretvori u NO 3) i sigurno je prihvaćena kao GDC u vodi za piće. Visoke koncentracije nitrata nalaze se uglavnom u podzemnim vodama, što je naslijeđe uporne opstrukcije vode (posebno podzemnih voda) i mineralnih promjena u vezi sa geohemijskim karakteristikama vodonosnih stijena. U vodi natopljenoj vodom koncentracija nitrata u pravilu nije visoka, a preostali smrad je povezan s vodenim vlaknima. Krivac može biti pojava masovne kontaminacije vodom i otpadnim vodama, što će spriječiti nitrate.
Nitriti, kao nestabilna jedinjenja, ne akumuliraju se u vodi u toksičnim koncentracijama, pa nemaju nikakvog značaja kao hidroksid koji sadrži methemoglobin.
Jedan od najvažnijih razloga za nastanak karijesa je nedostatak fluora u vodi za piće i kao rezultat toga nedostatak fluora u organizmu. Čuvajte se direktnog prisustva fluora u vodi za piće i rizika od karijesa. Fluorid će zajedno sa kalcijumom i fosforom osigurati tvrdoću i mekoću četkica i zuba.
Fluorid ima hematogeni učinak nakon namakanja scilikointestinalni trakt. S jedne strane, fluor stimulira proces mineralizacije zuba, s druge strane, rezultirajući fluorapatitisom, mijenja strukturu tvrdih tkiva zuba, čime se povećava njihova otpornost na hemijske i biološke karijesogene faktore, koji djeluju na usta su prazna.
U površinskim vodama važna je koncentracija jona fluora do 0,5 mg/l, a voda ovih voda je korisna za većinu srednjih i velikih mjesta. Optimalna koncentracija fluora u vodi za piće je 0,7 do 1,2 mg/l. Niske koncentracije fluorida povećavaju težinu karijesa. Višak fluora (iznad 1,5 mg/l) dovodi do fluoroze, koja utiče na reproduktivno zdravlje, posebno pamuka. Učestalost respiratornih bolesti i visoke koncentracije fluora su pouzdane.
Kada je sadržaj fluora ispod 0,5 mg/l, preporučuje se fluoridna voda iz slavine, što smanjuje pojavu karijesa za 65-70%. Vrijedi zapamtiti da je apsorpcija fluorida iz vode 20% brža nego iz proizvoda, što osigurava pažljivu ugradnju prije fluorizacije vode. Sa trenutnom fluorizacijom vode, njen sadržaj fluora je između 70-80% dozvoljenog maksimalnog nivoa za klimatski region kože. Kada je fluor prisutan iznad nivoa mora, može doći do defluorizacije u vodi.
Mešavina hemijskih elemenata i soli tipična za prirodno skladištenje vode u vodi za piće može sadržati prisutne hemikalije i supstance koje se gube u industrijskim i poljoprivrednim vodama, kao i višak tečnosti i tokove koji se dodaju vodi u roku od sat vremena od uzorkovanja u postrojenjima za prečišćavanje vode. Za njih je uspostavljen GDK, kako je predstavljeno u SanPiN-ima. Jedan od ovih elemenata je višak aktivnog hlora, koji se dodaje nekontaminiranoj vodi. Da bi se postigao efekat kontaminacije, preparati koji sadrže hlor se dodaju u malim količinama, tako da nakon 30 minuta kontakta sa vodom i hlorom (dovoljnim za smanjenje vegetativnih oblika mikroorganizama) u vodi postoji određeni višak ( višak u vodi) između 0,3 i 0,5 mg/l. Velike količine će dodati neprijatan miris vodi, posebno zbog prisustva fenola u vodi i prisustva halogeniranih ugljikohidrata, koji mogu biti kancerogeni.
| Statistika na temu: | |
|
Biramo rolete za prozore balkona i lođa
Roletne na balkonu optimalno su rješenje za miran i svakodnevni životni prostor... Neturbo koraljna boja u unutrašnjosti Integracija plave i koraljne boje u unutrašnjosti
I jedna od ovih boja od koje možete postići odlične... Sadnja i briga o rododendronu Kanadski rododendron Sadnja i njega
U stranoj literaturi, rododendroni se unose u grupu biljaka da rastu. | |