Odaberite čitatelje
Popularne statistike
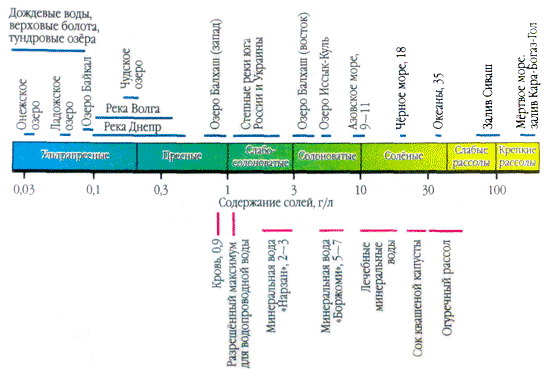
Ako kap prirodne vode nanesete na površinu i trljate je dok ne ispari, tada će se na mjestu kapljice vidjeti bijele razdvojenosti - a soli u vodi kristaliziraju. Prisutnost soli u prirodnim vodama povećava se tisućama puta. Na primjer, litra kišnice sadrži jedan ili više desetaka miligrama soli. A u litru vode iz utoka Kara-Bogaz-Gol (Kaspijsko more) - 300 g, možda trećina mase.
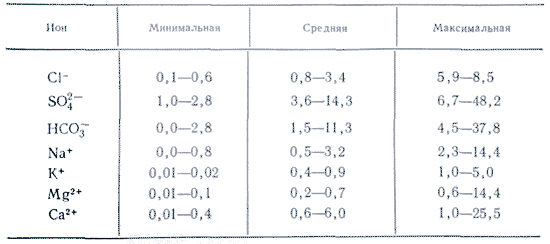
U primjenama s vodom, više soli je važno kao ioni. U prirodnim vodama važna su tri aniona ( hidrokarbonat HCO 3 -, klorid Cl -і sulfat SO 4 2-) i nekoliko kationa ( kalcij Ca 2+, magnezij Mg 2+, natrij Na+і kalij K+) - nazivaju se glavni ioni. Ioni klorida dodaju vodi slan okus, ioni sulfata, ioni kalcija i magnezija su gorki, ioni hidrokarbonata nisu slatki. Mirisi u slatkim vodama su preko 90-95%, au visoko mineraliziranim vodama - preko 99% svih rijeka. Donja granica koncentracije za glavne ione je 1 mg/l, pa se u nekim slučajevima, npr. za morske i neke podzemne vode, glavnim komponentama mogu dodati i Br - , B 3+ , Sr 3+ itd. Dodatak K + iona broju glave i leđa. U podzemnim i površinskim vodama ovi ioni u pravilu zauzimaju različit položaj. Samo ioni K+ u atmosferskim padalinama mogu igrati glavnu ulogu.
Proteionski oblik glavnih komponenti snage uvijek je koristan za niskomineralizirane vode. Kada se koncentracija između iona poveća, tada će doći do interakcija, izravne asocijacije. proces, reverzna disocijacija. U tom slučaju nastaju pridruženi ionski parovi, na primjer MgHCO 3 + CaHCO 3 + .
S priljevom klimatskih i drugih umova, kemijsko skladištenje prirodnih voda se mijenja i proizvodi karakteristične obrasce, neke specifične za različite vrste prirodnih voda (atmosferske padavine, rijeke, jezera, podzemne vode).
Atmosferske padavine Sve prirodne vode su najmanje mineralizirane, ali iza kemijskog skladištenja njihovih tvari, smrad nije ništa manje raznolik od ostalih prirodnih voda. Jerelomovo skladište su aerosoli atmosfere. Skladište ima niz različitih vrsta. Kada postoji prosječna bogata mineralizacija atmosferskih padavina u europskom dijelu Rusije u rasponu od 10-20 mg/l i ekstremne vrijednosti za cijeli teritorij 3-4 i 50-60 mg/l iona Ovo skladište karakterizira strogošću, a srednji anioni su najvažniji SO 4 2- ili HCO 3 - , a sredina kationa se drži na razini udaljenosti kako bi se sačuvao Ca 2+ ili Na +. Kako bi se izbjegao vjetar s mora, zbog mehaničkog uklanjanja soli vjetrom povećana je koncentracija klora u otpadu. Kao rezultat konzervacije, koncentracija Cl - u vodi pada, a SO 4 2-, Ca 2+ i Mg 2+, međutim, raste. Razlog kretanja umjesto SO 4 2- i Ca 2+ je obogaćivanje atmosfere aerosolima kontinentalnog kretanja. Kako se svijet pomiče dublje u kontinent, dio morskih aerosola se ispire. Koncentracija SO 4 2- pokazuje najveće promjene. Ako se dodatak Ca 2+ i Na + veže mineralnom pilom tla i pora, na čijoj je površini uvijek prisutna sol, tada se dodatak SO 4 2 stavlja s jedne strane, oksidacija SO 2 i H 2 S, inače - porast kiselih soli sa slanih površina.
Nemoguće je dobiti približnu procjenu velikog broja čestica soli koje se dižu iz tla, slanih jezera, na površini leda, gnojidbe i listopadnih tvari koje se oslobađaju kao kemijske i metalurške tvari. one se oslobađaju u atmosferu kao rezultat drugih ljudskih aktivnosti, a zatim se isperu padalinama.
Voda veći dio rijeke leže u hidrokarbonatnu klasu. Iza skladištenja kationa, ova voda može sadržavati i kalcij; Još su rijetke hidrokarbonatne vode s visokim sadržajem magnezija i natrija. Prirodne vode hidrokarbonatne klase imaju najveću količinu vode niske mineralizacije (sadržaj ukupne soli do 200 mg/l).
Rijeke s vodom koja doseže sulfatnu klasu gotovo su bezbrojne. Smrad je širi, pogotovo u stepskim smoothiejima i to često u praznima. U skladištu kationa u prirodnim vodama sulfatne klase, kao iu vodama hidrokarbonatne klase, prevladava kalcij. Međutim, brojne rijeke u sulfatnoj klasi imaju prekomjernu težinu natrija. Prema mineralizaciji voda sulfatne klase značajno premašuje vodu hidrokarbonatne klase. Riječne sulfatne vode niske (sadržaj krutine do 200 mg/l) i srednje (sadržaj krutine od 200 do 500 mg/l) mineralizacije rijetko se ravnomjerno povećavaju. Najkarakterističnije za ovu rijeku je niska (sadržaj soli od 500 do 1000 mg/l), što visoka (sadržaj soli preko 1000 mg/l) mineralizacija vode.
Rijeke čija voda dostiže razinu klorida jednako su rijetke kao rijeke čije vode sadrže sulfate. Ispred ovog teritorija nalaze se najvažniji stepski krajevi, ali uzalud. Najvažniji kationi prirodnih voda su kloridne klase, uglavnom natrij. Vode kloridne klase imaju visoku mineralizaciju - preko 1000 mg/l, iznad 500 do 1000 mg/l.
Karakteristike ionskog skladištenja riječne vode provode se do ljetnog razdoblja. Do raspjevanog svijeta, karakterizira skladište i tijekom sata ledopada. To znači da se tijekom proljetne sezone izbjegava manja mineralizacija vode.
Postoji dosljedan obrazac u distribuciji skladištenja iona u riječnoj vodi u Rusiji. Postoji opći trend povećanja mineralizacije vode na širem teritoriju europskog dijela Rusije iz dana u dan i od početka spuštanja. Zonalnost ionskog skladištenja riječnih voda objašnjava se djelovanjem klimatski svjesnih umova sadašnjeg vremena i klimom prošlosti. Razina vlažnosti tla i stijena, prisutnost lako hlapljivih soli u njima i slanost tla prirodni su rezultat bogatog priljeva različitih klimatskih umova. Uništiti zonalnost kemijskog skladišta vode rijeke Rusije i važnost skladišta vrsta i umova njihove kontaminacije.

Mineralizacija i kemijsko skladištenje jezerske vode Promjena od rijeke do rijeke mijenja se na vrlo širokim granicama. Rijeke s mineralizacijom vode iznad 100-200 mg/l, iz nekog razloga bilo je smradova, rijetka su pojava, dok je mineralizacija jezerske vode čak niska, nekoliko desetaka mg/l (potpuno mali porasti od daske) do vrlo visoka 3 -3,5% (slana jezera s ružinom slanom vodom do ruba prožetom solima). Na sadržaj mineralizacije utječe skladištenje iona u jezerskoj vodi. Nitko nije svjestan zakona, snage i kemijskog skladištenja riječne vode. Povećanom mineralizacijom jezerske vode dolazi do brzog porasta iona u njenom skladištu sljedećim slijedom: HCO 3 - →SO 4 2- →Cl -; Ca 2+ →Mg 2+ →Na + . Kada mineralizacija dosegne 500-1000 mg/l u jezerskoj vodi prevladavaju hidrokarbonatni ioni, iznad 0,1% - najčešće sulfatni, a nakon 0,3-0,5%, ovisno o litološkim karakteristikama vode slatka voda - sulfatna ili kloridna voda . U skladištenju kationa u jezerskim vodama važna je uloga kalcija, uštedi se manje od 0,1-0,2%. Kako se mineralizacija dalje povećava, natrij počinje igrati tu ulogu. Zadržavaju magnezij, kao i sve druge vode, u međupoložaju tijekom svih mineralizacija. Razlog ovakvoj podjeli ionskog sastava leži u različitim vrstama soli. Najvažniji dio slatkih jezera, kao što su rijeke, iza skladišta hidrokarbonatno-kalcijevih voda.
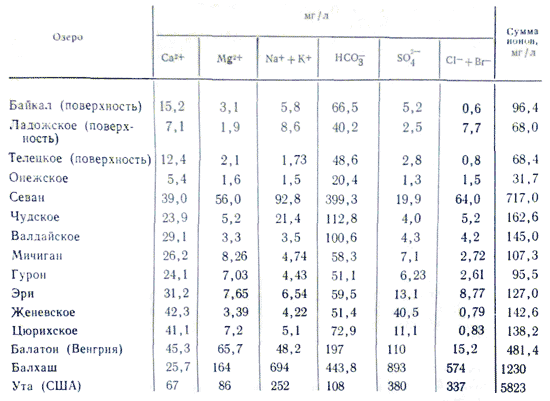
zaliha morska voda odlikuje se velikom količinom soli. U kontinentalnim vodama najčešće se promatraju sljedeći omjeri koncentracija: HCO 3 - > SO 4 2- > Cl - i Ca 2+ > Mg 2+ > Na + ili Ca 2+ > Na + > Mg 2+, zatim za boćate vode. i morske vode, počevši od halal mineralizacije od 1 g/kg, mijenja se odnos: Cl - > SO 4 2- > HCO 3 - i Na + > Mg 2+ > Ca 2+. Promjena u odnosu između riječnih i morskih voda objašnjava se nedavnim napretkom u važnosti niskokvalitetnih soli u svijetu povećane mineralizacije vode. Ukupno, oni i polovica glavnih komponenti čine 99,99% svih komponenti u oceanskoj vodi i mineralnim tokovima.
Između elemenata glavnog skladišta soli oceanske vode, između kože i njihovog zbroja, nalazi se praktični čelik u odnosu na koncentraciju. Preostali yogo dov U. Ditmar, vykonav novu kemijsku analizu (kloridi, sulfati, kalcij, magnezij, natrij) 77 uzoraka vode dostavljenih iz svih oceana s različitih dubina ekspedicije na "Challengeru": u vodi na otvorenom oceanu bez obzira na apsolutna koncentracija ugljičnog dioksida između glavnih komponenti glavnog skladišta soli uvijek je konstantna (Dittmarov zakon). PID s Viparovvannya Vyparovvannya, tupost, dosadna tannna lodiv sabati uši soli, potplat sljeza, ale -ahled u Morskiye, inozemstvo u međuprostorima nije za prostranstvo prostranstva da ne zmiju. Takav rang, yakshcho vídomo, je vrijeme dušikovih Kilkosti soli I koncentrata, osnovne komponente 1 kg vode prije koncentrata istog Sastojka, lišaj za jedno od obožavanja može izračunati skladište spasa od oceansko drive. U kontekstu takvog "referentnog" sastojka postoji "kloritet", koji je nekoliko grama iona klora, što je ekvivalentno količini halogena (uključujući fluoride, koji nisu taloženi nitratom) prisutnih u 1 kg morske vode (dodijeljeno Sorensenu). Stabilnost zaliha oceanske vode lako se uništava priljevom kontinentalnog otjecanja, koje se osvježava, u područjima estuarija i u blizini unutarnjih mora s otežanom izmjenom vode s oceanom. U skladištu glavnih komponenti koncentracija kationa kalcija i magnezija, kao i zbroj koncentracija aniona slabe kiseline (HCO 3 -, CO 3 2-, H 2 BO 3 -) značajno su niži za 1% u stabilizaciji sp Dodan na vezu s derivatiziranim karbonatnim kalcijem iz vode u površinskim kuglicama i razgradnjom vode na glinu.
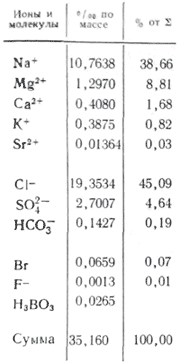
Koncentracija mikroelemenata u tableti je mala, tako da količina smrada prelazi 0,01% težine svih otopljenih soli. Iz krajnjeg alarma V.V. Gordeva i A.P. Prati se lizicin, u kojem najviše koncentracije uključuju litij (180 µg/l), rubidij (120 µg/l), barij (18 µg/l), najmanje - zlato (0,004 µg/l), elemente rijetke zemlje (manje od 0,001 µg k) radij (10 -7 µg/l).
Što je more izoliranije od oceana, to se skladištenje njegove vode više razlikuje od skladištenja vode u oceanu. Od primarne važnosti su izmjena vode s oceanom, odnos između volumena kontinentalnog otjecanja i volumena mora, dubina mora i priroda kemijskog skladištenja vode u rijeci koja se u njega ulijeva.
Podzemne vode Uznemiravaju ih ljubičaste boje kemijskog skladišta i ionskog skladišta. Spremnici vode dolaze u svim klasama i grupama vrsta. Prvo skladište podzemnih voda prvo je pohranjeno u svijesti o njihovom nastanku i onečišćenju.
Prirodna voda održava pH vrijednost manje stabilnom, budući da snažno smanjuje kiselost kiseline ili baze. Dodate li kap koncentrirane klorovodične kiseline u litru destilirane vode, pH će pasti sa 7 na 4. Dodate li kap klorovodične kiseline u litru riječne vode s pH = 7, pH vrijednost se može promijeniti. Kiseline i baze koje konzumiraju prirodnu vodu neutraliziraju ugljikov dioksid i hidrokarbonatni ioni otopljeni u njoj:
H + + HCO 3 - ↔ H 2 O + CO 2
OH - + CO 2 ↔ HCO 3 -
Hidrokarbonatni ioni neutraliziraju kiseline koje se gube u vodi taloženjem iz atmosfere ili nastaju kao rezultat vitalnosti organizama. Otpornost na vodu i kisele kiseline izravno je povezana s koncentracijom hidrokarbonatnih iona. Najosjetljivije rijeke na njih su jezera Karelije, Finske, Skandinavije; u njihovim vodama praktički nema takvih iona.
Organska rijeka prirodnih voda je kompleks istinski razgrađenih i dobro oblikovanih rijeka organskih akumulacija. Ovisno o situaciji, organske rijeke prirodnih voda mogu se podijeliti na one koje teku iz slivnog područja i uspostavljaju se u blizini vodnog tijela. Do prve skupine dolazi glavni dio humusnih smjesa, koje se vodom ispiraju iz tla, treseta, šumskog humusa i drugih vrsta prirodnih otopina, koje uključuju višak biljaka, te organske tvari, koje dolaze iz industrije i vlade. otpadne vode. Među huminskim kiselinama za hidrokemiju od najvećeg su interesa huminske i fulvinske kiseline. Otrovne kiseline su svojstvene humusu (huminska kiselina), smrad ne postoji u živim biljnim i životinjskim tkivima. Odnos između njih u različitim tresetima i tlima je različit. U tlima crnica važnije su huminske kiseline, a u podzolastim tlima fulvokiseline.
Koncentracija organske tvari u prirodnim vodama, varirajući u širokim intervalima, najveća je u močvarnim vodama (koje uz visoku koncentraciju humusne tvari ponekad dosežu 500 mg/l i više) i rijekama s močvarnim konobama, a močvarna voda je zaraženo smeđa boja do 300° i iznad platinsko-kobaltne ljestvice vrijednosti boje (dodatak prirodne vode dodaje huminske kiseline). Visoka koncentracija inoda organskog govora koncentrirana je u podzemne vode Još veće koncentracije mogu se pojaviti u prirodnim vodama onečišćenim industrijskim i kućnim otpadnim vodama. Nezagađene prirodne vode uzrokuju malo protoka organske tvari. Na primjer, za B.A. Skopincev, u oceanskoj vodi koncentracija organske tvari postaje manja od 2,0-5,4 mg/l (u prosjeku 3,0 mg/l, au riječnoj vodi u prosjeku 20 mg/l).
U nekim površinskim vodama, posebno u rijekama iz močvara, naslage humusa čine glavni dio kemijskog sastava vode. Nakon što su rijeke, a zatim jezera i mora dobro prozračeni, organski dijelovi vode podložni su promjenama, au tlu se proces oksidacije najvećim dijelom završava prijelazom iz jednostavne mineralne tvari. Drugi, postojani dio se gubi i nakuplja u vodenim tijelima.
U hladnim klimatskim zonama (tundra) ima vrlo malo organskih viškova, a tamo rezervoari vode ne moraju sadržavati huminske kiseline. A u zoni šuma, posebno četinjača, gdje organskih ostataka ima u izobilju, a smradovi se ne otapaju na površini, umjesto huminskih kiselina nalazi se nekoliko desetaka miligrama po litri. Huminske kiseline ne samo da zakiseljuju vodu u akumulaciji, već vežu gotovo sve važne metale u kompleksu.
Kada hladnu vodu iz slavine natočite u bocu i stavite je na toplo mjesto, na stjenkama će se pojaviti mjehurići plina. godine uništen je Gazi hladna voda a bili su vidljivi pri zagrijavanju (zagrijavanjem se mijenja koncentracija plinova). Ovo je kiseli plin, dušik i ugljikov dioksid. Intenzitet plina u vodi ima tendenciju pada s porastom temperature, što je povezano s porastom kinetičke energije molekula plina, što smanjuje gravitacijske sile molekula vode. Sve prirodne vode su izvori plina. Kisika O 2 i ugljičnog dioksida CO 2 ima najviše u površinskim vodama, a kisika H 2 S i metana CH 4 ima najviše u podzemnim vodama. U značajnim količinama, CO 2 može biti prisutan iu vodi iz dubokih horizonata. Osim toga, sve prirodne vode stalno sadrže dušik N2.
Kisen (O 2) nalaze u prirodnoj vodi u izgledu razbijenih molekula. Kisen, kao jako oksidacijsko sredstvo, igra posebnu ulogu u formiranju kemijskog skladišta prirodnih voda. Kisen dolazi iz vode kao rezultat procesa fotosinteze koji se odvijaju u prirodi i iz atmosfere. Kisen se koristi za oksidaciju organskih tvari, kao iu procesu degeneracije organizama. Koncentracija otopljene kiseline u prirodnim vodama varira između 0 i 14 mg/l, uz intenzivnu fotosintezu, potonje su moguće i veće koncentracije. Zbog dugotrajne koncentracije kiseline u površinskim vodama zbog niskih faktora, njezina se koncentracija značajno mijenja s trajanjem proizvodnje, godišnjim dobom i sudbinom. Malo je vjerojatno da će ostaci mrtve kiselosti zaostati zbog promjena sunčevog zračenja, a fotosinteza u potpunosti ovisi o njoj; kako dan odmiče, kiselost se nakuplja, a mračno doba dopušta da se konzumira. Kiselo je neophodno za uništavanje većine organizama koji obitavaju u vodama. Kao jaka oksidacijska kiselina, igra važnu sanitarnu i higijensku ulogu, podržavajući brzu mineralizaciju organskih viškova.
Ugljični dioksid (CO2) biti zadužen za vodu kako bi vidio razgradnju molekula u plin CO2. Međutim, dio (oko 1%) stupa u interakciju s vodom, otapajući ugljičnu kiselinu:
CO 2 + H 2 O ↔ H 2 CO 3
Pazite da ne dodajete CO 2 i H 2 CO 3 i ispod ugljičnog dioksida u najvećoj mjeri (CO 2 + H 2 CO 3). U prirodnim vodama ugljični dioksid je prisutan prije procesa oksidacije organskih tvari, što je uzrokovano prisutnošću CO 2 kako u vodi tako iu tlima i površinama po kojima voda teče. Pred njima se čuje dah vodenih organizama i različiti pogledi biokemijska razgradnja i oksidacija organskih viškova. U nekim podzemnim vodama nalazi se važan izvor ugljičnog dioksida i vulkanskih plinova koji se mogu vidjeti iznad tla, a čija je pojava povezana s otplinjavanjem plašta i složenim procesima metamorfoze sedimentnih pora koji se tamo zbivaju u glina ispod utoka visoka temperatura. Stoga se često izbjegavaju visoke razine ugljičnog dioksida u podzemnim vodama i glinenim rezervoarima. Otpuštanje ugljičnog dioksida iz atmosfere vodom važnije je za morske i oceanske vode, a manje za kopnene vode. Zamjena ugljičnog dioksida ugljičnim dioksidom nastaje tijekom fotosinteze. Čak i uz intenzivnu fotosintezu, ako dođe do smanjenja CO 2 nalik plinu, preostali ioni mogu se vidjeti iz HCO 3 - iona:
HCO 3 - ↔ CO 3 2- + CO 2
Ugljični dioksid se također koristi za razgradnju karbonata:
CaCO 3 + CO 2 + H 2 O ↔ Ca(HCO 3) 2
Također se koristi kemijska vitrifikacija aluminosilikata. Promjena CO 2 u vodi, posebno u površinskim vodama na kopnu, također se opaža kada se ispusti u atmosferu. Zapaljena atmosfera CO 2 od velike je važnosti za CO 2 koji se nalazi u površinskim vodama, regulirajući ga tamo. Između atmosfere CO 2 i površinskih voda CO 2 postoji kontinuirana izmjena, usmjeravajući uspostavljanje ravnoteže između njih, temeljene na Henry-Daltonovom zakonu. Parcijalni tlak ugljičnog dioksida u atmosferi je vrlo malen (33 Pa), pa bez obzira na njegovu veliku snagu (pri tlaku od 1013 hPa i temperaturi od 12 °C do 2166 mg/l), ravnoteža između vode i atmosfere postiže se s vrlo malo mu s CO 2 u vodi. Pri parcijalnom tlaku CO 2 u atmosferi od 33 Pa njegova će koncentracija u vodi biti 2166,0,00033 = 0,715 mg/l (pri 12 °C). Zbog površinskih voda kopna, u kojima se odvijaju razni procesi razgradnje organske tvari i tla, provodi se veća količina CO 2 te se stoga ispušta u atmosferu. Osim ako je fotosinteza vrlo jaka, ako je CO 2 prisutan, CO 2 se može ukloniti iz atmosfere. Umjesto ugljičnog dioksida u prirodnim vodama, vrlo je promjenjiv - do nekoliko desetina puta do 3000-4000 mg/l. Najniža koncentracija CO 2 uočena je u površinskim vodama, posebice mineraliziranim (more, slana jezera), a najveća u podzemnim i onečišćenim otpadnim vodama. U rijekama i jezerima koncentracija CO 2 rijetko prelazi 20-30 mg/l.
Rozchinny molekularni dušik (N 2)- Najstabilniji plin u prirodnim vodama. Kemijski najstabilniji i biološki najvažniji dušik, unesen u glinene kuglice u oceanu ili podzemnoj vodi, brzo se mijenja samo pod djelovanjem fizičkih sila (temperatura i tlak). U slučaju površinskih voda, dušik ima važnu ulogu u vodoopskrbi. U prirodi postoji rašireno povećanje biogenog dušika, što je rezultat denitrifikacije.
Plin metan (CH4) dopiru do najvećih plinova i podzemnih voda. U plinovitoj fazi podzemnih voda često prevladavaju dušik, ugljikov dioksid ili metan. Glavni izvor stvaranja metana su dispergirani organski spojevi u stijenama. Metan, koji je važan u ugljikohidratima, često se pojavljuje u značajnim koncentracijama u dubokim podzemnim vodama zatvorenih struktura povezanih s naslagama nafte. U niskim koncentracijama, metan se akumulira u prirodnim jezerima, gdje se može vidjeti s mazge kada su visoka stabla položena, kao iu naslagama na dnu oceana u područjima visoke biološke produktivnosti.
Plin Sirkovoden (H 2 S) Ona je jedan od produkata razgradnje bjelančevinaste tvari, koja se skladišti u vašem skladištu, pa se stoga njezina nakupina često skladišti u kuglicama na dnu s vodom zbog truljenja raznih organskih viškova. U nižim dijelovima dubokih jezera i mora, gdje postoji dnevna izmjena vode, često se razvija zona dubokih voda. Uz parcijalni tlak vode u atmosferi ispod nule, prisutnost vode u površinskim vodama je nemoguća. Osim toga, vino se oksidira kiselošću, koja se otapa vodom. U rijekama je duboka voda ograničena uglavnom na pridnene bazene, posebno tijekom zimskog razdoblja, kada je prozračivanje vodenog tijela otežano. Prisutnost vodene vode u prirodnim, nezagađenim površinskim vodama rijedak je fenomen. Voda se mnogo češće nalazi u podzemnim vodama izoliranim od površine te u jako onečišćenim površinskim vodama, u kojima vina služe kao pokazatelj teške kontaminacije i anaerobne drenaže.
Osim onih u vodi, niz elemenata: dušik, fosfor, silicij, aluminij, slina, fluor prisutni su u koncentracijama od 0,1 do 10 mg/l. Smrad se naziva mezoelementi (od grčkog "Mesos" - "srednji", "srednji").
Dušik se u obliku nitrata NO 3 - gubi u vodi i stolnoj vodi, a u obliku aminokiselina, soli (NH 2) 2 CO i amonijevih soli NH 4 + - odlaganjem organskih viškova.
Fosfor je u vodi prisutan u obliku hidrofosfata HPO 3 2- i dihidrogenfosfata H 2 PO 3 - nastalih razgradnjom organskih viškova.
Silicij je bitna komponenta kemijskog skladištenja prirodnih voda. To je zbog prisutnosti drugih komponenti posvuda u prisutnosti silicija u planinskim stijenama, a mala raznolikost preostalih komponenti objašnjava minimalan sadržaj silicija u pitkoj vodi. Koncentracija silicija u prirodnim vodama je nekoliko miligrama po 1 litri. U podzemnim vodama raste i često pada na desetke miligrama po 1 litri, au vrućim termalnim vodama - do stotina. Osim temperature, na osjetljivost silicija snažno utječu pH pomaci. U površinskim vodama postoji mala količina silicija, koja se reducira u silicijev dioksid (125 mg/l na 26 °C, 170 mg/l na 38 °C), što ukazuje na prisutnost procesa u vodi koji mijenjaju njegovu koncentraciju. Prije njih potrebno je uvesti vodene organizme bogate silicijem, od kojih će mnogi, primjerice dijatomejske alge, tvoriti svoj silicijski kostur. Osim toga, kremena kiselina, kao slaba kiselina, razlikuje se od ugljične kiseline:
Na 4 SiO 4 + 4CO 2 + 4H 2 O = H 4 SiO 4 + 4NaHCO 3
Smanjuje nestabilnost silicija zbog sklonosti silicijeve kiseline da se pretvori u gel. U vrlo malo mineraliziranim vodama silicij postaje izvor, a ponekad i važan dio kemijskog sastava vode, bez obzira na to. Prisutnost silicija u vodi je ozbiljan nedostatak u tehnologiji, jer kada je kipuća voda potpuno suha, silicij stvara vrlo tvrdi silikatni kamenac u kotlovima.
Aluminij je prisutan u blizini vode zbog prisutnosti kiselina na glini (kaolin):
Al 2 (OH) 4 + 6H + = 2SiO 2 + 5H 2 O + 2Al 3+
Glavno ležište je glina. Organski ostaci (u daljnjem tekstu C) u dodiru s njima smanjuju sadržaj do dvovalentnog, koji se potpuno apsorbira u obliku hidrokarbonata ili soli huminskih kiselina:
2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 = 4Fe(HCO 3) 2
Kada voda s otopljenim Fe 2+ ionima dođe u dodir s vodom, ona brzo oksidira, stvarajući smeđi talog Fe(OH) 3 hidroksida. Ove godine se pretvara u močvarnu rudu - smeđi korov (limonit) FeO(OH). Karelijska močvarna ruda izvađena je u 18.-19. stoljeću za vađenje obloge.
Plava pljuvačka na površini vode je Fe(OH) 3, koja se otapa kada podzemna voda koja sadrži Fe 2+ ione dođe u dodir s površinom. Često se izgube u taljenoj polietilenu, ali ih je vrlo lako razrezati: talina hidroksida će zaliječiti poderane rubove. Nakon što je tekućina na površini vode, istisnite otopinu hidroksida u uljnu posudu, kako se ne bi prelila.
U ovu skupinu spadaju elementi koji se u prirodnim vodama nalaze u vrlo malim koncentracijama pa se nazivaju mikroelementima. Njihova koncentracija varira u mikrogramima po 1 litri (mcg/l), a često ima i veće vrijednosti. Mikroelementi su najveća skupina elemenata u kemijskom sastavu prirodnih voda, a uključuju sve elemente periodnog sustava koji nisu obuhvaćeni prethodnim razmatranim skupinama komponenata. Mentalno se mogu podijeliti u pet podskupina: 1) tipični kationi (Li +, Rb +, Cs +, Be 2+, Sr 2+, Ba 2+ i tako dalje); 2) ioni važnih metala (Cu 2+, Ag +, Au +, Pb 2+, Fe 2+, Ni 2+, Co 2+ i tako dalje); 3) amfoterni kompleksi (Cr, Mo, V, Mn); 4) tipični anioni (Br -, I -, F -); 5) radioaktivni elementi. Mikroelementi su neophodni za normalan život biljaka, životinja i ljudi. Međutim, s povišenim koncentracijama mnogi mikroelementi su štetni i štetni za žive organizme. Zato se smrad često pretapa u mutne zvukove i kontrolira se njihova koncentracija. Uspješan uzgoj mikroelemenata otežan je zbog njihove male prisutnosti u prirodnim vodama, te zbog velike neizvjesnosti oblika njihove prisutnosti u vodama. I dalje je teško objasniti obrasce njihove migracije i režima, te stvara poteškoće u kemijskoj analizi. Na primjer, puno važni metali U visokim koncentracijama migriraju u vitalno, a ne u poremećeno stanje. Raspadnuti organski kompleksi stvaraju većinu metala, prije svega trovalentne metale s huminskim i fulvo kiselinama. Koncentracija kompleksiranih metala računa se prije koncentracije organskih kiselina. Izgled stijena je bogat metalnim hidroksidima. Moguće je da dolazi do adsorpcije organskih tvari na površini koloida, što im daje veću stabilnost pri razgradnji.
Skladište kemikalija prirodna voda znači prethodnu povijest, dakle. staze koje stvara voda u procesu svog kruženja. Brojni različiti govori u takvoj vodi talože se, s jedne strane, iz skladišta tih govora s kojima je tekla, s druge strane - iz umova s kojima su djelovali jedni s drugima. Sljedeći čimbenici mogu dodati vodu u kemijski rezervoar: planinske stijene, tlo, živi organizmi, ljudska djelatnost, klima, reljef, vodni režim, vegetacija, hidrogeološki i hidrodinamički uvjeti itd. Pogledajmo pobliže čimbenike koji utječu na skladište vode.
Raspadanje tla i atmosferske padavine, koje se filtriraju kroz tlo, rezultiraju razgradnjom stijena i minerala. To je jedan od najvažnijih utjecaja na tlo koji dotječe u kalupno skladište prirodnih voda, a rezultira povećanom koncentracijom ugljičnog dioksida u tlu, što se očituje tijekom isušivanja živih organizama i korijenskog sustava u tlu te biokemijske razgradnje. organskih viškova. Kao rezultat toga, koncentracija CO 2 u zraku tla raste od 0,033%, u atmosferskom zraku, do 1% ili više u zraku tla (u važnim glinastim tlima, koncentracija CO 2 u zraku tla Vjetar doseže 5 -10%, čime se daje snažno agresivno djelovanje prema dobi pasmina). Još jedan čimbenik koji pojačava agresivno djelovanje vode koja se filtrira kroz tlo je organska tvar - zemljišni humus koji se uspostavlja u tlu transformacijom suvišne vegetacije. Kod skladištenja humusa u posudi s aktivnim reagensima, prvo moramo navesti huminske i fulvinske kiseline te jednostavne tvari, kao što su organske kiseline (limunska, kisela, okstoinska, jabučna i dr.). Iskopavanje tla, bogatog organskim kiselinama i CO 2, često se ubrzava kemijskom vitrifikacijom aluminosilikata koji se nalaze u tlu. Slično tome, voda koja se filtrira kroz tlo ubrzava kemijske vibracije aluminosilikata i karbonatnih stijena koje se nalaze ispod tla. Vapnyak lako otapa niskokvalitetni (do 1,6 g/l) kalcijev hidrokarbonat:
CaCO 3 + H 2 O + CO 2 ↔ Ca(HCO 3) 2
U cijelom europskom dijelu Rusije (Krim Karelija i regija Murmansk) ležišta, kao i dolomit MgCO 3 .CaCO 3, leže blizu površine. Stoga je ovdje važno da voda sadrži kalcijev i magnezijev hidrokarbonat. U rijekama kao što su Volga, Don, Pivnichna Dvina i njihovim glavnim pritocima, kalcijev i magnezijev hidrokarbonat postaje 3/4 do 9/10 svih otopljenih soli.
Soli se konzumiraju iz vodenih tijela i kao rezultat ljudske aktivnosti. Dakle, ceste se posipaju natrijevim i kalcijevim kloridima kako bi se otopio led. U proljeće, kloridi teku zajedno iz otopljene vode u rijeci. Količinu klorida u rijeke europskog dijela Rusije donijeli su ljudi. U blizini rijeka na kojima se nalaze velika mjesta, ovaj dio je bogatiji.
Reljef lokaliteta neizravno ulijeva rezervoar vode, apsorbirajući uklanjanje soli iz tla. Dubina erozivnog usjeka rijeke olakšava dolazak do rijeke s više mineraliziranih podzemnih voda iz nižih horizonata. Tko može primiti druge vrste depresija (riječne doline, škrape, škrape), koje poboljšavaju odvodnju sliva.
Klima stvara sparnu pozadinu, što omogućuje odvijanje većeg broja procesa u formiranju kemijskog rezervoara prirodnih voda. Klima prvenstveno ovisi o ravnoteži topline i vode, koja određuje naslage tla i volumen protoka vode, a samim time i razrjeđenje ili koncentraciju prirodnih poremećaja i mogućnost uništenja rijeka ili njihova pada pod opsadu.
Vrlo je važno dovesti kemijsko skladište vode u veliki protok i promijeniti život vodenog tijela i njegov odnos tijekom vremena. U razdoblju otapanja snijega voda u rijekama, jezerima i akumulacijama ima nižu mineralizaciju, u razdoblju kada najviše života dolazi iz podzemnih i podzemnih voda. Zbog toga se namještaj koristi za regulaciju površine vode i uklanjanje vode iz njih. U pravilu se drenažni bazeni obnavljaju tijekom proljetne sezone, ako je voda plime i oseke manje mineralizirana.
Kemijsko skladištenje vode može biti različito, a na mjestu čestica anorganskih i organskih tvari mogu ležati fragmenti. Tekući kroz različite dijelove zemlje, voda razgrađuje soli (kalcij, magnezij, itd.) prisutne u njima.
Rotirajući na površini zemlje, voda se nakuplja s plinovima, otapajući ih. Prirodne vode su odvojene od kemijskog skladišta u jednu vrstu, tako da ih tvore plinovi, bazični ioni, biogene i organske tvari te mikroelementi.
Veliki dotok vode i skladištenje kemikalija primjenjuje se na tlo i gredicu. Voda uklanja mineralne i organske tvari iz tla, što se posebno pažljivo čuva u prvim fazama rada.
Plinski režim u prirodnim i umjetnim ležištima nastaje kombinacijom plinova koji se gube iz atmosfere i kao rezultat kemijskih procesa. Veliki broj otopljenih plinova ostaje zbog temperature, tlaka i prisutnosti soli u vodi.
Ovi plinovi, a prije svega kiselost i ugljikov dioksid, jednostavno su neophodni za život vodenih organizama. Što ih je više u blizini vode, to je bolje za ljude u bazenu. Međutim, visok sadržaj vode, metana i dušika smanjuje vitalnost živih bića.
Jedan od najvažnijih plinova koji su stalno prisutni u površinskim vodama je kiseli plin. Značajne količine vode nalaze se u kemijsko-biološkim vodama.
Glavne džerele se pune kiselom vodom
- atmosfera - pod rastućim vjetrom, stapa se s površinskim kuglicama vode;
- Fotosinteza mikroskopskih algi.
Pri visokim temperaturama kiselost vode se mijenja, a pri niskim povećava.
Kiselost vode u prirodnim vodama je manja od 100%, jer volumen ovog plina ide u oksidaciju organskih tvari. Kada postoji masivan razvoj algi (zimi) u velikim vodenim površinama, kiselost može doseći 150-200%.
Ugljični dioksid (CO 2) prisutan je u velikim količinama u svim prirodnim vodama. U ovom slučaju većina ugljičnog dioksida prisutna je u otopljenom stanju, a mala količina ugljičnog dioksida (do 1%) može u interakciji s vodom stvoriti ugljičnu kiselinu.
Povećanje koncentracije ugljične kiseline u smjesi za optimalnu razinu temelji se na koncentraciji organskih tvari. Posebno je važno regulirati proizvodnju kiselosti i ugljične kiseline.
Da bi se utvrdio kemijski sastav vode i priroda njegove promjene, moraju se provesti laboratorijska ispitivanja. Osnovni podaci o kiselosti vode mogu se dobiti posebnim uređajem koji se koristi za ispitivanje. je jasan blok s dva jarka i skalom boja.
U prisutnosti ovih i drugih kemikalija, voda koja se ispituje razvija jasnu boju koja je usklađena sa ljestvicom boja na ljestvici. Ljestvica boje kože određena je razinom kiselosti vode.
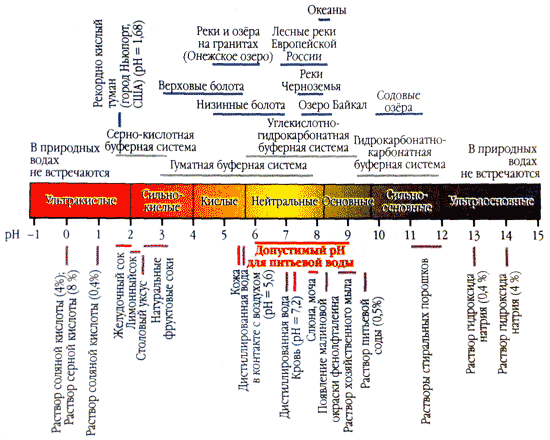
Kiselost vode (pH) karakterizira aktivnu reakciju medija. Što je pH vrijednost bliža nuli, veća je koncentracija vodenih iona u otopini, sredina je kiselija.
Optimalni pokazatelj kiselosti vode za ljude je u uskom rasponu od 7,2-7,4, a najviše 7,6. Uz tako jednak pH, voda ne teče na ljudsku kožu i sprječava razmnožavanje mikroorganizama.
Ako je pH vrijednost viša od 7,8, takva voda iritira kožu (osobito osjetljivu) i mikroorganizmi se u vodi lako razmnožavaju. U Dodatku, visoka rabarbara pH potiče korozivnu aktivnost vode, što značajno utječe na učinkovitost posjedovanja i komunikacije.
Najviše razine pH vode (8-8,8) uočavaju se u drugoj polovici vegetacijske sezone, kada biomasa algi dostiže svoj najveći razvoj, a procesi fotosinteze se odvijaju maksimalnim intenzitetom.
Kao rezultat kemijskih reakcija poput vode. Razina pH postupno se mijenja, kako s vodom tako i s uzimanom vodom.
Čvrstoća vode uvelike utječe na pH vrijednost. Da, da meka voda pH rabarbare je manji od 7,0, a gorke može doseći i 9,0.
Tvrdoća vode određuje se umjesto Ca CO2 (). Kada dođe do promjena temperature, talog pada na stijenke bazena, filtere, izmjenjivače topline i drugu opremu.
Prema standardima, tvrdoća vode ne bi trebala prelaziti 30°dH, gdje je 1°dH = 10 mg CaO/l. Tvrdoća vode može se promijeniti ako stoji duže vrijeme. Tijekom zime, dodatno se smanjuje tijekom kišne sezone.
Oksidacija vode određena je upotrebom raznih organskih i mineralnih tvari.
Količina oksidacije pokazuje koliko se oksidacijom gubi razgradnjom organskih tvari (mg/l). Tijekom tekuće vegetacijske sezone, oksidacija vode se mijenja od 10 do 30 mg po 1 litri ili više.
Skladište kemijske vode. U prirodi je uobičajeno da voda uvijek sadrži više ili manje svojih mineralnih soli. Korak skladište minerala Voda je određena prirodom tla ili tala koja leže do vodonosnika ili površinskih rezervoara vode.
Količina mineralnih soli, kao i vode, izražava se u mg/l.
Organski govori. Od njih su najvažnije riječi putovanja stvorenja, fragmenti smrada mogu sadržavati razne patogene mikrobe. Neizravni higijenski pokazatelj prisutnosti ili prisutnosti ovih tvari u vodi je oksidacija vode.
Oksidacija vode. Količina kiselosti (mg) koja se troši na vanjsku oksidaciju organskih tvari sadržana u 1 litri vode (označuje se kao mg/l). Što je manja količina kiselosti u vodi, to je manja količina kiselosti na površini oksidacije u 1 litri vode s organskim spojevima. Na primjer, oksidacija čiste podzemne vode nije veća od 2-4 mg/l, riječna voda nije veća od 7 mg/l.
Jedan od pokazatelja moguće prisutnosti organskih kiselina u vodi je količina u njoj otopljene kiseline (mg). U čistim vodama ispuštalo se 3-6 mg/l kisele vode, a u onečišćenim znatno manje, sve do potpunog nestanka.
Prisutnost amonijaka, nitratnih soli i dušičnih kiselina može se uočiti u prisutnosti amonijaka, nitratnih soli i dušičnih kiselina. Amonijak je proizvod faze klipa truljenje organskog otpada od kuhanja, a soli dušične i dušične kiseline konačni su produkti mineralizacije organskog otpada. Vidljivo je da je voda dugo bila začepljena.
Prisutnost soli klorovodične i kisele kiseline u vodi je pokazatelj moguće kontaminacije vode izmetom životinja i ljudi (fekalna kontaminacija). Smatrajte da 1 litra čiste prirodne vode sadrži nešto više od 20-30 mg klorida.
Tvrdoća vode. Indiciran je umjesto soli kalcija i magnezija. Podijelite vodu na male komadiće, komad po komad. Vidi se prirodna tvrdoća vode - tvrdoća sive vode, specifična tvrdoća, koja se mijenja kuhanjem ili stajanjem, a ne preljevom, koja se ne smanjuje nakon kuhanja vode.
Povrće i meso loše se kuhaju u tvrdoj vodi, jer se proteini koji se nalaze u njima spajaju s kalcijem i magnezijem u anorganske tvari koje se ne apsorbiraju u crijevima čovjeka.
Takva voda nije prikladna za higijenske postupke: sadrži prekomjernu količinu soli koja se prelijeva, a nepoželjni ostaci talože se na kosi i stvaraju mittu.
Tvrdoća vode za piće može biti veća od 7 mg/l. Ova se karakteristika može izraziti u stupnjevima (1 mg/eq tvrdoće vode jednak je 2,8 °). Tvrda voda je voda koja ima više od 20°, meka je voda ispod 10°.
Sipaju se soli. Voda koja izlije nije jeftina, ali u prevelikim količinama daje gorak metalni okus i žućkastu ili žućkastosmeđu aromu, smanjujući bistrinu. Voda za piće smije sadržavati do 0,5 mg/l (u hladnim vodnim tijelima) i 1,0 mg/l (u podzemnim vodnim tijelima).
Fluor. Što god da je u pitkoj vodi, značajno se slijeva na zube. Povećanjem koncentracije dolazi do fluoroze (pojave tamnih mrlja na caklini zuba), što dovodi do njihovog daljnjeg propadanja, a ako nema dovoljno karijesa, učestalija je karijesna bolest. Voda ne sadrži više od 1,5 mg/l fluora, optimalna kiselost je 0,7-1,0 mg/l. Ako se fluor ne ukloni, vodu treba pojedinačno fluorizirati i dodati natrijev fluorid.
Prirodne (kopnene) vodene površine imaju prirodne procese samopročišćavanja, jer ih čovjek ne može nadvladati:
*Bez ultraljubičastog zračenja;
*Taloženje i odvajanje važnih čestica;
*Oksidacija organskih tvari zbog sadržaja O2;
* Mineralizacija organskih viškova zbog rasta bakterija.
strana 1
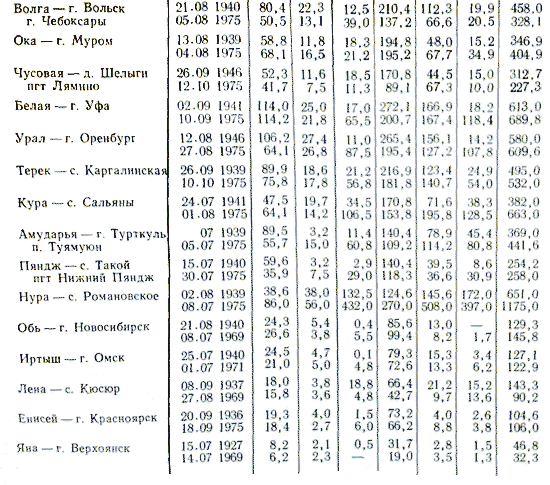
Skladištenje riječne vode određeno je količinom i snagom potoka koji u njih utječu s tla i vjetra, kao i otpadne vode iz industrijskih i komunalnih poduzeća.
Klasifikacija akumulacije riječne vode prikazana je na sl. 3.24 je pojednostavljen i ne pokazuje se uvijek učinkovitim.
Kao što su pokazala opsežna istraživanja skladištenja riječne vode, regulacija ispuštanja vode iz spremnika ne zahtijeva toliko značajnih promjena koliko se riječna voda može napraviti. koristeći sadašnje metode analiza.
Zbog sezonskih osobitosti, promjene u akumulaciji riječne vode moraju se obnoviti u vrijeme projektiranja instalacije. Klasa važnih kationa kože podijeljena je u tri skupine: kalcij, magnezij i natrij. Na svoj način, skupina kože podijeljena je u četiri vrste vode, koje se identificiraju prema broju iona. Krema sadrži važne katione, riječna voda sadrži ione K, NH4, Fe2, Mn2, Cu2, Zn2, Ni2, Fe3, Al3 te u manjim koncentracijama niz drugih iona.
Da bi se razumjela priroda promjene snage i protoka riječne vode duž naftonosnih formacija, 1957. Bušači TatNIPInafte sami su izbušili pet injekcijskih bušilica.
U blizini naselja A industrijska otpadna voda može opskrbiti veliki dotok industrijske otpadne vode u skladište riječne vode.
Uz vodstvo iz tablice. 3 slike pokazuju da skladištenje riječne vode varira preko širokih granica. Riječne vode koje teku kroz plodna područja pune su karbonata i bogate su kalcijem. Riječne vode koje teku kroz suha područja (primjerice, u zapadnom dijelu Sjedinjenih Država) sadrže više sulfata, manje kalcija, a time i manje karbonata. Bilo bi pogrešno zanemariti količinu organske tekućine koja se prenosi vodama, čiji se fragmenti pretvaraju u naftu.
Kemijska akumulacija podzemne vode na obalnim vodozahvatima je drugim riječima akumulacija riječne vode, koja se na svoj način označava kao akumulacija atmosferskih oborina, ali i kao akumulacija snježnog, olujnog i podzemnog otjecanja iv. U atmosferi se nakuplja kišnica i snijeg velika količina kiselost, ugljični dioksid, dušikov oksid, amonijeve soli, au onečišćenom okolišu industrijskih područja, kao tvar se misli, dodaju im se piljevina, bakterije, sirup, produkti izgaranja ugljena, nafta i druge tvari.
Kao rezultat toga, samo mala količina začepljene kanalizacijske vode teče u blizini rijeke, što rezultira iscrpljivanjem skladišta otpadnih riječnih voda, što eliminira mogućnost daljnje likvidacije.
Smrad se koncentrira u obliku minerala, na primjer, gipsa Ca8O4 - 2H2O, mirabilita Na28O4 - 10H2O, a također ulazi u skladište morske i riječne vode.
Gornje riječne vode (kao i jezera i vode) karakterizira obilje njihove akumulacije, što je rezultat života biljaka i bića koja se nalaze u blizini vode, a glavni događaj su proljetne poplave i daske koje ispiraju s obale znatan broj čestica tla. Istodobno, u blizini naseljenih područja, ispusti otpadnih voda i otpad iz industrijskih poduzeća često se slijevaju u riječno akumulacijsko područje.
Skladište kemikalija u rijeci prepoznaje sezonske fluktuacije. Najveća mineralizacija riječne vode događa se u razdoblju kada je rijeka živa podzemnom vodom, a najmanja je zbog kišne sezone ili trajanja ledenih ploča. Skladištenje riječnih voda leži u rukama fizičko-geografskih umova. U nadzemnim zonama mineralizacija vode je niska. Mineralizacija se također mijenja kako rijeka teče u pritoku, vodozahvatu koji se nalazi u drugim kalupnim bazenima.
Skladište riječne vode, kao i otpada, čuva se do kraja vremena. Najmanje zamuljenosti i najveća mineralizacija događa se zimi, ali obrnuto događa se tijekom poplava, osobito u proljeće. U vrijeme sudbine, meteorološki odvodi, ljetni vjetrovi i drugi čimbenici teku u skladište riječne vode.
Kemijsko skladište prirodnih voda vrlo je sklopivo. Imaju više obitelji kemijski elementi, koji se računaju u dijelovima grama ili cijelim, pa čak i desecima ili stotinama grama po litri vode. To su elementi koji se nalaze u vodi i pojava iona ili molekula koje stvaraju složene strukture, uključujući i organske.
Stadij i priroda mineralizacije vode na ovom i drugim lokalitetima je poremećena vodom. Umjesto razgradnje neletećih mineralnih i djelomično organskih tvari u vodi karakterizira se količina suhog viška (glavna količina, ukupnost klorida, sulfata, karbonata i bikarbonata, livadskih i livadsko-zemljanih metala). Vode koje sadrže veliku količinu mineralnih soli mogu dati neugodan slan ili gorko-slan okus, pa je količina suhe vode za piće podložna sanitarnoj praksi zbog utjecaja na okusnu snagu vode u rijeci čak i 1000 mg. /l. Eksperimentalna istraživanja su pokazala da je optimalna (organoleptička svojstva) hranjiva voda koja sadrži 200-400 mg soli po litri. Voda sa suhim viškom do 1000 mg/l naziva se svježom, a iznad 1000 mg/l - mineraliziranom.
Promjene u primarnoj razini mineralizacije vode, koje nisu uzrokovane prirodnim razlozima (proljetne poplave), mogu se smatrati pokazateljem onečišćenja vode rijekama trećih strana.
Kloridi su u vodi koncentrirani posebno u obliku natrijevog klorida i, najmanje, u obliku drugih spojeva (magnezijev klorid, itd.). U prirodnim vodama kloridi se pojavljuju kao rezultat uklanjanja iz tla. Područja sa slanim tlom posebno su bogata kloridima. Kloridi su važni kao tvari koje mijenjaju okus vode i utječu na fiziološke funkcije organizma. Počevši od koncentracije od 500 mg/l, kloridi uzrokuju suzbijanje izlučivanja puža, što se očituje u promjeni kiselosti i jačine soka puža, koji truje. Kao rezultat toga, ubrzat će se evakuacija života s broda. U koncentraciji većoj od 1000 mg/l, klorid dovodi do promjene diureze, što može biti posebno štetno za osobe koje pate od srčanih bolesti i zdravstvenih problema. Kod koncentracija iznad 350 mg/l klorida smjesi dodati slanu vodu.
Kloridi se mogu izgubiti u vodi iz fekalija, rezina, kuhinjskog otpada, za komunalnu vodoopskrbu, vodu koja nije osjetljiva na kontaminaciju, kloridi mogu biti važni kao neizravni pokazatelj svakodnevne kontaminacije vode. U koga se ne procjenjuje koncentracija klorida, kolika je promjena u satu i potezu vode, zatim. povećati u odnosu na hitne, prirodne koncentracije. Jaka prisutnost klorida i amonijaka u biljkama s visokom oksidacijom i neugodnim bakteriološkim pokazateljima ukazuje na sanitarnu problematiku ove vode.
Sulfati u količinama većim od 500 mg/l, dodaju vodeno-slani gutljaj u vodu, u koncentraciji od 1000-1500 mg/l, najvjerojatnije suzbijaju lučenje skutuma, djeluju laksativno na crijeva i dovode do negativan stav prema ukusu ljudi.napoji svoje jakove. Sulfati mogu biti pokazatelj onečišćenja površinskih voda životinjskim izmetom, budući da je skladišni dio proteinskih tijela sumpor koji se razgradnjom i daljnjom oksidacijom pretvara u sol sumporne kiseline.
Tvrdoća vode pokazuje koncentraciju dvovalentnih metalnih kationa trava u njoj, prije svega kalcija i magnezija. Ioni Ca(2+) i Mg(2+) mogu biti povezani s različitim anionima (HCO 3 , SO 4 , Cl , CO 3 , HNO 3 itd.).
Karbonatnu tvrdoću označavaju kalcijevi i magnezijevi hidrokarbonati Ca(HCO 3) 2, Mg(HCO 3) 2 i karbonati CaCO 3, MgCO 3 . Zagrijavanjem vode dolazi do razgradnje karbonatne smjese (promjene u 2), pri čemu hidrokarbonati prelaze u karbonate.
Razlika između kalcijevih i magnezijevih karbonata znatno je manja nego kod hidrokarbonata, stoga se kod kipuće vode tvrdoća smanjuje. Tvrdoća vode, sastavljena od hidrokarbonata kalcija i magnezija, naziva se karbonat. Karbonatna tvrdoća često se kombinira s konvencionalnom tvrdoćom, ali ih je nemoguće izjednačiti jednu po jednu. Uz visoku koncentraciju magnezijevog hidrokarbonata u vodi, razlika između karbonatne i konvencionalne tvrdoće može biti značajna. Vrijednost relativne tvrdoće praktički izbjegava sadržaj vlage u vodi, koja umjesto hidrokarbonata tla sadrži metale (Ca, Na, Mg, K) i druge soli slabih kiselina. Sadržaj vlage u vodi važan je za proces koagulacije vode tijekom pročišćavanja. Razlika između pravne i konvencionalne okrutnosti tzv postojana okrutnost, povezan je s velikom količinom kalcija i magnezija, povezan s drugim anionima osim hidrokarbonata (Cl, SO 4, NO 3 i tako dalje).
Tvrdoća vode jedan je od bitnih kriterija za tvrdoću vode za piće. Tvrda voda nije prikladna za državne potrebe: povrće, meso i perad se kuhaju u tvrdoj vodi. vanjski izgled, ukus i slatkoću čaja, loše je piti slatko, jer se u vodi natrij u njemu zamjenjuje kalcijem i magnezijem, zbog čega se stvara talog sadržaja kalcija i magnezija. Tvrda voda može uzrokovati mučninu i suhu kožu; U uređajima za grijanje u sustavima opskrbe toplom vodom tvrda voda stvara manji talog, što komplicira njihov rad.
Što se tiče zdravlja, visoka gorčina može se smatrati jednim od čimbenika koji pridonose razvoju urolitijaze, kao što je gore rečeno. U sljedeća tri sata raspravljat će se o prehrani kako bi se proždrljivost ubacila u kardiovaskularni sustav; Postoje podaci o stopi smrtnosti od srčanih bolesti zbog konzumacije meke vode za piće. Ova hipoteza nije potvrđena u mnogim zemljama.
Ulazi u nevidljivi dio stvorenog organizma i koristi se za stimulaciju diholnih enzima (hemoglobin, katalaza i dr.). Može se vidjeti kako napušta tijelo kroz crijeva. Tijelo svoje potrebe u prostoriji zadovoljava uglavnom živeći sa svojom okolinom, koliko je veliko ući u tijelo s piti vodu, nema pravi fiziološki značaj. Otpuštanje Fe(2+), Fe(3+) događa se u svim prirodnim vodama u različitim koncentracijama. Pri visokim koncentracijama u vodnim tijelima, rezultat je skupljanje otpadnih voda. Kada se voda distribuira kroz čelične (nepocinčane) cijevi, korozija se povećava umjesto da u njih ulazi. Toksični učinak gutanja na tijelo nije poznat. Kod oralne primjene veće doze (300 mg/kg ili više) korištene su za prevenciju gastroenteritisa bez znakova intoksikacije. Dakle, prisutnost vode u blizini vode nije zbog estetske i svakodnevne iritacije, pa vodi daje kalamutnost, pripremljenost i gorak metalni okus. Osim toga, povećane koncentracije saliniteta u vodi potiču razvoj pljuvačnih bakterija, a kada vodovodne cijevi odumru, dolazi do nakupljanja teškog sedimenta koji mijenja njihov promjer. Utvrđeno je da do povećanja bistrine i boje vode dolazi pri utapanju i kiselih i oksidnih tekućina, au svim slučajevima smrad je posljedica prisutnosti hidroksida u tekućini. Kada se koncentracija vode promijeni na 0,3 mg/l, bistrina i boja vode su jednake standardu. Metalni okus vode javlja se u koncentraciji od 0,5 mg/l. Na temelju metode eksperimentiranja s populacijom jasno je da uz znatno veći kapacitet infuzije (preko 1,0 mg/l) voda može izazvati različite učinke na kožu osobe, uključujući svrbež i suhoću.
Da bi se boja vode dovela do traženog standarda, u postrojenjima za obradu vode koriste se posebne metode bojenja vode. Da bi se zamijenili sulfati, kloridi i druge soli u vodi, voda se desalinizira daljnjim dodavanjem različitih soli. Desalinizacija se provodi metodama destilacije, ionske izmjene i elektrodijalize. U umovima lokalne vodoopskrbe koristi se metoda zamrzavanja prirodnom hladnoćom i komadno zamrzavanje.
Za dezinfekciju vode koriste se sljedeće metode: prozračivanje (oksidacija) i namakanje s daljnjim ekstrahiranjem hidroksida iz tekućine, koja je uklonjena, stajanjem i filtracijom: te vikoristička koagulacija vode i kationizacija.
Za omekšavanje vode (trajno ili djelomično uklanjanje kationa vode Ca(2+) i Mg(2+) koriste se reagens metode koje se temelje na tretiranju vode reagensima koji se spajaju s ionima kalcija i magnezija praktički nezamjenjivim tvarima koje su pod opsadom. (zbog čega je potrebno dodati gašene pare u kombinaciji sa sodom). Praktičnije Također smo usvojili metodu ionske izmjene za omekšavanje vode od smola za ionsku izmjenu. Omekšavanje vode metodom ionske izmjene može se izvesti korištenjem N-kationskih kupki, H-kationskih kupelji, paralelnih ili naknadnih N-Na-kationskih kupelji.
U sanitarno-kemijskoj analizi vode važnu ulogu ima koncentracija amonijačnih soli, dušičnih i dušičnih kiselina (nitrita i nitrata), što je posredni pokazatelj onečišćenja vode organskim otpadnim tvarima.
Organske tvari stvorene prirode koje se nalaze u vodi podložne su razgradnji, a mineralizacija dolazi zbog prisustva mikroorganizama koji obitavaju u vodi. Ovaj proces se odvija intenzivnije za toplog vremena i zbog prisutnosti kiseline u vodi. Mineralizacija organskih tvari koje sadrže dušik odvija se u dvije faze. U prvoj fazi, koja se naziva amonifikacija, proteini i tvari se raspadaju na aminokiseline i soli. Razgradnja proteina odvija se pod utjecajem anaeroba (B.putrificus, B.sporogenes i dr.), fakultativnih anaeroba (B.micoides i dr.) i aeroba (B.mesentericus, B.subtilis i dr.). Amonifikaciju sjemena uzrokuju urobakterije i mikrobi. Ostaci amonijaka su proizvod klipa, čija prisutnost govori o svježoj organskoj fermentiranoj vodi.
U drugoj fazi mineralizacije - nitrifikaciji - amonijak i soli se oksidiraju u nitrite (uz pomoć B.nitrosomonas), a mirisi se oksidiraju u nitrate (uz pomoć B.nitrobakter). Za rekonstituciju amonijevih soli nitritom potrebno je potvrditi da je voda nedavno bila onečišćena organskim tvarima. Nitrati su završni produkt mineralizacije organskih spojeva, a njihova prisutnost pokazatelj je dugotrajne nečistoće vode.
Dušikovi spojevi omogućuju nam da utvrdimo prisutnost onečišćenja vode, a tu će biti i informacija o starosti onečišćenja. Dakle, ako se prisutnost amonijaka u vodi tijekom ponovljenih analiza više ne povećava, moguće je zaključiti da je voda kontaminirana i da više nije kontaminirana. Istovremeno s amonijakom u vodi se pojavljuju nitriti, što ukazuje na sustavno onečišćenu vodu u novije vrijeme. A ako u vodi ima amonijaka, nitrita i nitrata, onda to ukazuje na izrazito nepovoljno vodospremište, odnosno na dugogodišnje i stalno onečišćeno vodospremište.
Ako voda svakodnevno pokazuje nitrate, amonijak i nitrate, to znači da su procesi mineralizacije organskih tvari završeni, a time i nečistoće eliminirane.
Međutim, treba napomenuti da onečišćenje vode tokovima organskog otpada nije jedini razlog za pojavu tokova koji sadrže dušik u vodi. U čistim vodama koje leže duboko, kiselost se može pojaviti svaki dan, pri čemu se stvara ispiranje kako bi se obnovio mineralni otpad nitrita i amonijaka. Ova vrsta povećanja koncentracije amonijaka soli i nitrita u dubokim interstratalnim vodama ne ukazuje na opstrukciju. Ostali znakovi začepljene vode javljat će se tijekom dana.
Amonijeve soli, nitriti i nitrati u vodi namočenoj u vodi mogu biti produkti razgradnje, a produkti su razgradnje organskih tvari taloženja u vodi. Tvari koje sadrže dušik mogu se izgubiti iz vodoopskrbe kroz industrijske otpadne vode, kao i iz otpadnih voda iz područja koja su jasno gnojena tvarima koje sadrže dušik.
Dakle, za ispravnu higijensku procjenu prisutnosti dušikovih spojeva u vodi potrebno je utvrditi razlog njihove pojave u vodi. O nečistoći organske tvari u vodi povoljnije može govoriti činjenica da se paralelno s mineralnim spojevima koji sadrže dušik u vodi pojavljuju i drugi pokazatelji nečistoće: kemijski (visoka oksidativnost) i mikrobiološki (mala količina, visoka količina). U voda iz pipe, koja može biti nezagađena, amonijeve soli i nitriti kao neizravni pokazatelji epidemioloških problema u vodi gube na značaju. Naime, u vodi iz slavine koja nije onečišćena klorom, umjesto amonijevim solima, koncentracija ne smije biti veća od 0,5 mg/l, jer dodatkom manjeg broja djelatnih tvari - kloramina, vitrat klora za infekciju povećava se 2-4 puta.
U lokalnim vodoopskrbama, zbog utvrđenih higijenskih standarda, dušik iz amonijeve soli dopušten je do 0,1 mg/l, nitritni dušik - do 0,002 mg/l. Kao rezultat aktivnosti minerala ili algi, značajni su kao pokazatelji začepljenja i dopušteno ih je koristiti umjesto vode.
Od neovisnog interesa je gubitak nitrata, koji uzrokuju methemoglobinemiju pri visokim koncentracijama smrada. Prema trenutnoj teoriji o nitratima u crijevima, ljudi nastavljaju nitrirati pod priljevom bakterija koje oklijevaju u novoj. Vlaženje nitrita provodi se dok se methemoglobin ne stabilizira. Dakle, bolest se temelji na istom stadiju kiselog gladovanja, čiji se simptomi najprije manifestiraju u djece, osobito u prsima, što je važno u slučaju individualne pripreme (razrijediti suhe mliječne smjese s vodom za miješanje potrošiti) ili kada se konzumira, cijena vode za pitya. Starija djeca i odrasli manje su osjetljivi na bolest, jer imaju jače izražene kompenzacijske mehanizme. Koncentracija nitrata je jednaka 45 mg/l (kada se pretvori u NO 3) i sigurno se prihvaća kao GDC u vodi za piće. Visoke koncentracije nitrata nalaze se uglavnom u podzemnim vodama, što je naslijeđe dugotrajne opstrukcije vode (osobito podzemne vode) i mineralnih promjena u vezi s geokemijskim karakteristikama stijena koje nose vodu. U vodi natopljenoj vodom, koncentracija nitrata, u pravilu, nije visoka, a preostali smrad povezan je s vodenim vlaknima. Krivac može biti pojava masivnog onečišćenja vode i otpadnih voda, što će spriječiti nitrati.
Nitriti, kao nestabilni spojevi, ne nakupljaju se u vodi u toksičnim koncentracijama, pa nemaju značaj kao hidroksid koji sadrži methemoglobin.
Jedan od najvažnijih razloga za nastanak zubnog karijesa je nedostatak fluorida u vodi za piće i, posljedično, nedostatak fluorida u organizmu. Čuvajte se izravne prisutnosti fluorida u pitkoj vodi i opasnosti od karijesa. Fluorid će zajedno s kalcijem i fosforom osigurati tvrdoću i mekoću četkica i zuba.
Fluor ima hematogeni učinak nakon namakanja scilikointestinalni trakt. S jedne strane, fluor potiče proces mineralizacije zuba, s druge strane, rezultirajući fluorapatitisom, mijenja strukturu tvrdih tkiva zuba, čime se povećava njihova otpornost na kemijske i biološke karijesogene čimbenike koji djeluju na usta prazna.
U površinskim vodama važna je koncentracija iona fluora do 0,5 mg/l, a voda ovih voda je vikorist za većinu srednjih i velikih mjesta. Optimalna koncentracija fluorida u vodi za piće je 0,7 do 1,2 mg/l. Niske koncentracije fluora povećavaju težinu karijesa. Višak fluora (iznad 1,5 mg/l) dovodi do fluoroze, što utječe na reproduktivno zdravlje, posebice pamuka. Učestalost bolesti dišnog sustava i visoke koncentracije fluora je pouzdana.
Kada je sadržaj fluora ispod 0,5 mg/l, preporuča se fluorizirati vodu iz slavine, čime se smanjuje učestalost zubnog karijesa za 65-70%. Vrijedno je zapamtiti da je apsorpcija fluorida iz vode 20% brža nego iz proizvoda, što osigurava pažljivu instalaciju prije fluoriranja vode. Sa trenutnom fluorizacijom vode, njen sadržaj fluorida je između 70-80% maksimalno dopuštene razine klimatskog područja kože. Kada je fluor prisutan iznad razine mora, može doći do defluorizacije vode.
Mješavina kemijskih elemenata i soli tipičnih za prirodno skladištenje vode u vodi za piće može sadržavati prisutne kemikalije i tvari koje se gube u industrijskim i poljoprivrednim vodama, kao i višak tekućine. i tokove koji se dodaju vodi unutar sat vremena od uzorkovanja na postrojenjima za pročišćavanje vode. Za njih je uspostavljen GDK, kao što je predstavljeno u SanPiNs. Jedan od tih elemenata je višak aktivnog klora koji se dodaje nekontaminiranoj vodi. Za postizanje učinka nezagađenosti dodaju se pripravci koji sadrže klor u malim količinama, tako da nakon 30 minuta kontakta s vodom i klorom (dovoljno za smanjenje vegetativnih oblika mikroorganizama) u vodi postoji određeni višak ( višak u vodi).između 0,3 i 0,5 mg/l. Velike količine vodi će dodati neugodan miris, posebno zbog prisutnosti fenola u vodi i prisutnosti halogeniranih ugljikohidrata koji mogu biti kancerogeni.
| Statistika na temu: | |
|
Biramo rolete za prozore balkona i lođa
Roletne na balkonu su optimalno rješenje za miran i svakodnevni boravak... Neturbo koraljna boja u interijeru Integracija plave i koraljne boje u interijeru
I jedna od ovih boja, od kojih možete postići sjajne... Sadnja i njega rododendrona Sadnja i njega kanadskog rododendrona
U stranoj literaturi rododendroni se dovode u skupinu biljaka za uzgoj. | |