Válasszon olvasókat
Népszerű statisztikák
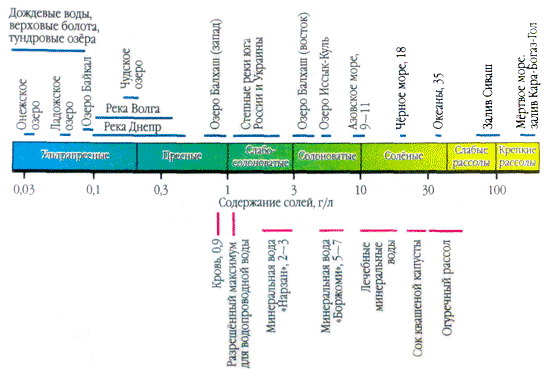
Ha egy csepp természetes vizet viszünk fel a felületre, és addig dörzsöljük, amíg el nem párolog, akkor a csepp helyén fehér leválás látható - és a vízben lévő sók kikristályosodnak. A sók jelenléte a természetes vizekben ezerszeresére nő. Például egy liter esővíz egy vagy több tíz milligramm sót tartalmaz. És egy liter vízben a Kara-Bogaz-Gol bemenetből (Kaszpi-tenger) - 300 g, talán a tömeg egyharmada.
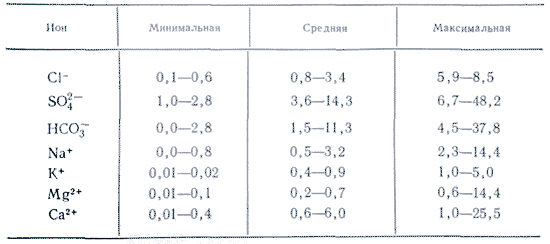
A vizes alkalmazásokban több só fontos ionként. A természetes vizekben három anion fontos ( szénhidrogén HCO 3 -, klorid Cl -і szulfát SO 4 2-) és számos kation ( kalcium Ca 2+, magnézium Mg 2+, nátrium-Na+і kálium K+) - fejionoknak nevezik. A kloridionok sós ízt adnak a víznek, a szulfátionok, a kalcium- és magnéziumionok keserűek, a hidrokarbonátionok nem ízletesek. Az édesvizekben a szagok több mint 90-95%, az erősen mineralizált vizekben pedig az összes folyó 99%-a. A főionok koncentrációjának alsó határa 1 mg/l, így bizonyos esetekben, például tengeri és egyes talajvíz esetén Br - , B 3+ , Sr 3+ stb. is adható a főkomponensekhez. K + ionok hozzáadása a fej és a hátsó ionok számához. A felszín alatti és felszíni vizekben ezek az ionok általában eltérő pozíciót foglalnak el. A légköri csapadékban csak a K+-ionok játszhatnak fő szerepet.
Az erő fő összetevőinek proteines formája mindig előnyös az alacsony ásványianyag-tartalmú vizek számára. Ha az ionok közötti koncentráció nő, akkor kölcsönhatások, közvetlen asszociációk lesznek. folyamat, fordított disszociáció. Ebben az esetben kapcsolódó ionpárok jönnek létre, például MgHCO 3 + CaHCO 3 +.
Az éghajlati és egyéb elmék beáramlásával a természetes vizek kémiai tárolása megváltozik, és jellegzetes mintákat hoz létre, amelyek egy része a különböző típusú természetes vizekre (légköri csapadék, folyók, tavak, talajvíz) jellemző.
Légköri csapadék Valamennyi természetes víz a legkevésbé ásványosodott, de anyagaik kémiai tárolása mögött a bűz nem kevésbé változatos, mint a többi természetes vizé. Jerelom raktára a légkör aeroszoljai. A raktár többféle típussal rendelkezik. Amikor Oroszország európai részén a légköri csapadék átlagosan gazdag mineralizációja 10-20 mg/l tartományban, szélsőértékek pedig a teljes területen 3-4 és 50-60 mg/l ion Ez a raktár jellemző sztringenciával, és a középső anionok a legfontosabbak SO 4 2- vagy HCO 3 -, a kationok közepét pedig a távolság szintjén tartják a Ca 2+ vagy Na + megtakarítása érdekében. A tenger felől érkező szél elkerülése érdekében a sók szél mechanikus eltávolítása miatt a klór koncentrációja megnő a hulladékban. A konzerválás eredményeként a Cl - vízkoncentrációja csökken, a SO 4 2-, Ca 2+ és Mg 2+ viszont emelkedik. A SO 4 2- és Ca 2+ helyett a mozgás oka a légkör kontinentális mozgás aeroszoljaival való feldúsulása. Ahogy a világ egyre mélyebbre kerül a kontinens felé, a tengeri aeroszolok egy része kimosódik. A SO 4 2- koncentrációja mutatja a legnagyobb változásokat. Ha a Ca 2+ és Na + adagolását egy ásványi talaj- és pórusfűrésszel kötik össze, amelynek felületén mindig só van, akkor az SO 4 2 adagolás az egyik oldalra kerül, SO 2 oxidáció, ill. H 2 S, egyébként - savas sók felemelkedése sós felületekről.
Lehetetlen hozzávetőleges becslést kapni a talajból, sóstavakból, a jég felszínére, a műtrágyázásból, valamint a kémiai és kohászati anyagként felszabaduló lombhullató anyagok nagyszámú sószemcséjére. más emberi tevékenységek eredménye, majd a csapadék elmossa.
Öntözze meg a folyó nagy részét feküdjön le a szénhidrogén osztályba. A kationok tárolása mögött ez a víz kalciumot is tartalmazhat; A magas magnézium- és nátriumkoncentrációjú hidrokarbonátos vizek még ritkák. A hidrokarbonátos osztályba tartozó természetes vizek tartalmazzák a legtöbb alacsony mineralizációjú vizet (összes sótartalom 200 mg/l-ig).
Szinte számtalan olyan folyó van, amelynek vize eléri a szulfátosztályt. A bűz szélesebb, különösen a sztyeppei turmixokban és gyakran az üresekben. A kationok tárolása során a szulfát osztályú természetes vizekben, akárcsak a szénhidrogén osztályú vizekben, a kalcium dominál. A szulfátosztályba tartozó számos folyóban azonban túlsúlyos a nátrium. A szulfát osztályba tartozó víz mineralizációja szerint jelentős a hidrokarbonát osztályba tartozó víz túllépése. Az alacsony (200 mg/l-ig szilárdanyag-tartalom) és közepes (200-500 mg/l-es szilárdanyag-tartalmú) folyók szulfátos vizei ritkán emelkednek egyenletesen. Legjellemzőbb erre a folyóra, hogy alacsony (sótartalma 500-1000 mg/l), ami magas (sótartalom 1000 mg/l feletti) víz mineralizációja.
A kloridszintet elérő folyók olyan ritkák, mint azok a folyók, amelyek vize szulfátokat tartalmaz. E terület előtt terülnek el a legfontosabb sztyeppei régiók, de hiába. A természetes vizek legfontosabb kationjai a klorid osztályba tartoznak, főként a nátrium. A kloridos osztályba tartozó vizek ásványossága magas - 1000 mg/l felett, 500-1000 mg/l felett.
A folyóvíz ionos tárolásának jellemzőit a nyári időszakig végezzük. Az énekes világig ez jellemzi a raktárt és a jégesés órájában. Ez azt jelenti, hogy a tavaszi szezonban elkerülhető a víz kevésbé mineralizálódása.
Az oroszországi folyóvíz iontárolóinak eloszlásában következetes minta van. Általános tendencia figyelhető meg a víz ásványosodásának fokozódása felé Oroszország európai részének nagyobb területén napról napra és a leszállás kezdetétől. A folyóvizek ionos tárolásának zónaszerűségét a jelenkor klímatudatos elméinek tevékenysége, illetve a múlt klímája magyarázza. A talajok és kőzetek nedvességtartalma, a bennük könnyen illékony sók jelenléte, a talajok sótartalma a különböző éghajlati elmék gazdag beáramlásának természetes eredménye. Pusztítsd el az oroszországi folyó vize vegyi raktárának zónáját, és szennyezettségük fajainak és tudatának raktárának fontosságát.

A tóvíz ásványosítása és vegyszertárolása A folyóról folyóra való váltás nagyon tág határokon változik. A 100-200 mg/l feletti víz mineralizációjú, valamiért büdös folyók ritkán fordulnak elő, míg a tó vizének ásványosodása még alacsony, több tíz mg/l (a deszkából teljesen kicsi emelkedés) nagyon magas 3 -3,5% (sós tavak rózsás sóoldattal a széléig sóval átitatva). A mineralizáció tartalmát a tóvíz iontárolása befolyásolja. Senki sem ismeri a folyóvíz törvényeit, erejét és vegyszertárolását. A tóvíz megnövekedett mineralizációjával gyorsan növekszik a tárolásában lévő ionok mennyisége a következő sorrendben: HCO 3 - →SO 4 2- →Cl -; Ca 2+ →Mg 2+ →Na + . Amikor a mineralizáció eléri az 500-1000 mg/l-t a tóvízben, a hidrokarbonát ionok dominálnak, 0,1% felett leggyakrabban szulfátosak, majd 0,3-0,5% elérése után a víz kőzettani jellemzőitől függően édesvíz - szulfátos vagy kloridos víz . A tóvizekben a kationok tárolásában a kalcium szerepe fontos, kevesebb mint 0,1-0,2%-ot takarítanak meg. Ahogy a mineralizáció tovább növekszik, a nátrium elkezdi játszani ezt a szerepet. A magnéziumot, mint minden más víz, köztes helyzetben tartják meg minden mineralizáció során. Az ionos összetétel ilyen felosztásának oka a különböző típusú sókban rejlik. Az üde tavak, így a folyók legfontosabb része a szénhidrogén-kalciumos vizek tárolása mögött.
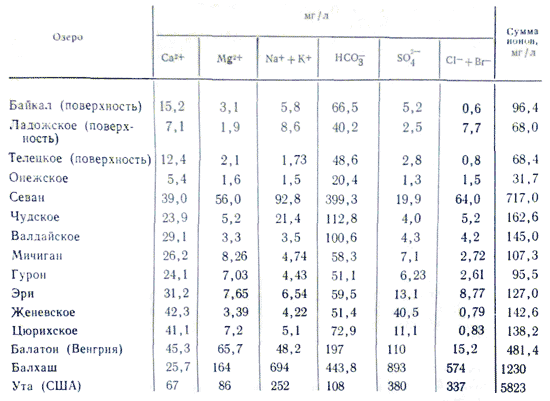
Készlet tengervíz nagy mennyiségű só jellemzi. Kontinentális vizekben leggyakrabban a következő koncentrációarányok figyelhetők meg: HCO 3 - > SO 4 2- > Cl - és Ca 2+ > Mg 2+ > Na + vagy Ca 2+ > Na + > Mg 2+, majd a brakkvíznél és tengervizekben 1 g/kg halal mineralizációtól kezdve az arány változik: Cl - > SO 4 2- > HCO 3 - és Na + > Mg 2+ > Ca 2+. A vizek folyami és tengervizei közötti kapcsolatának változását az magyarázza, hogy a közelmúltban az alacsony minőségű sók jelentősége a víz fokozott mineralizációjának világában történt. Összességében ezek és a fő összetevők fele adják az óceánvízben és az ásványvizekben lévő összes komponens 99,99%-át.
Az óceánvíz fő sóraktárának elemei között, a bőr és azok összege között a koncentráció szempontjából praktikus acél található. Maradt yogo dov U. Ditmar, vykonav új kémiai elemzés (kloridok, szulfátok, kalcium, magnézium, nátrium) 77 vízmintát szállítottak az összes óceánból a "Challenger" expedíció különböző mélységeiről: a nyílt óceán vízében, függetlenül a fő sóraktár fő alkotóelemei között a szén-dioxid abszolút koncentrációja mindig állandó (Dittmar törvénye). PID a Viparovvannya Vyparovvannya, tompaság, tompa tannna lodiv szombatok a sók tetvek, a mályvacukor talpa, ale -ahled Morskiye-ban, a külföld az interglesben nem arra való, hogy a hatalmasság hatalmassága ne kígyózik. Egy ilyen rang, yakshcho vіdomo, a salétromtartalmú Kilkosti sók I. koncentrátumainak ideje, 1 kg víz alapösszetevői ugyanazon Ingredi koncentrátumai előtt, az egyik istentisztelet zuzmója képes kiszámítani az üdvösségraktárt a oceansko meghajtó. Egy ilyen „referencia” összetevővel összefüggésben szó van a „klórtartalomról”, amely több gramm klórion, amely megegyezik az 1 kg tengervízben jelen lévő halogének mennyiségével (beleértve a fluoridokat is, amelyeket nem csap ki nitrát). (Sorensenhez rendelve). Az óceáni víztározó stabilitását a felfrissülõ kontinentális lefolyás könnyen tönkreteszi a torkolati területeken és a beltengerek közelében, ahol az óceánnal nehéz vízcsere van. A főkomponensek raktárában a kalcium- és magnéziumkationok koncentrációja, valamint a gyenge savas anionok (HCO 3 -, CO 3 2-, H 2 BO 3 -) koncentrációjának összege lényegesen, 1%-kal alacsonyabb. az sp stabilizálásában Hozzáadják a kötéshez a felszíni golyókban lévő vízből származó kalcium-karbonát származékkal és a víz agyagon történő lebontásával.
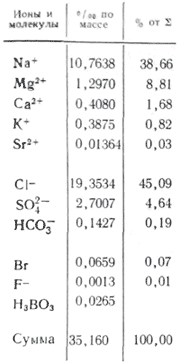
A mikroelemek koncentrációja a tablettában kicsi, így a bűz mennyisége meghaladja az összes oldott só tömegének 0,01%-át. A vonal hátsó riasztójából V.V. Gordeva és A.P. A lizicint nyomon követik, amelyben a legmagasabb koncentrációk a lítium (180 µg/l), a rubídium (120 µg/l), a bárium (18 µg/l), a legalacsonyabb az arany (0,004 µg/l), a ritkaföldfémek (kevesebb) mint 0,001 µg k) rádium (10-7 µg/l).
Minél jobban el van szigetelve a tenger az óceántól, annál jobban eltér a víz tárolása az óceánban lévő víz tárolásától. Elsődleges fontosságú az óceánnal való vízcsere, a kontinentális lefolyás és a tenger térfogata közötti kapcsolat, a tenger mélysége és a víz kémiai tárolásának jellege a belefolyó folyóban.
Földalatti vizek Zavarják őket a vegyszerraktár és az ionraktár lila színei. A víztárolás minden osztályba és típuscsoportba tartozik. A felszín alatti vizek első tárháza az első, amely a keletkezésük és a szennyeződésük tudatában tárolódik.
A természetes víz kevésbé tartja stabilan a pH-értéket, mivel erősen csökkenti a sav vagy bázis savasságát. Ha egy liter desztillált vízhez egy csepp tömény sósavat adunk, a pH-érték 7-ről 4-re csökken. Ha egy liter 7-es pH-jú folyóvízhez csepp sósavat adunk, a pH-érték megváltozhat. A természetes vizet fogyasztó savakat és bázisokat a benne oldott szén-dioxid és szénhidrogén-ionok semlegesítik:
H + + HCO 3 - ↔ H 2 O + CO 2
OH - + CO 2 ↔ HCO 3 -
A hidrokarbonát ionok semlegesítik azokat a savakat, amelyek a légköri lerakódások következtében elvesznek a vízben, vagy az élőlények életereje következtében keletkeznek. A vízzel és a savas savakkal szembeni ellenállás közvetlenül összefügg a szénhidrogén-ionok koncentrációjával. A legérzékenyebb folyók rájuk a Karélia, Finnország, Skandinávia tavai, ezek vizében gyakorlatilag nincs ilyen ion.
A természetes vizek szerves folyója valóban szétesett és jól megformált folyók szerves tározóiból álló komplexuma. A természetes vizek szerves folyói helyzettől függően a vízelvezető területről kifolyókra oszthatók, amelyek a víztest közelében létesülnek. Az első csoportba tartozik a humuszkeverékek nagy része, amelyeket vízzel kimosnak a talajból, tőzegből, erdei humuszból és egyéb természetes oldatokból, amelyek magukban foglalják a növényfeleslegeket, szerves anyagokat, amelyek az iparból és a kormányzatból származnak. szennyvíz. A hidrokémiában használt huminsavak közül a huminsavak és a fulvosavak a legérdekesebbek. A káros savak a humuszra (huminsavra) jellemzőek, a bűz az élő növényi és állati szövetekben nem létezik. Különböző tőzegekben és talajokban eltérő a kapcsolat közöttük. A feketeföldes talajokban a huminsavak, a podzolos talajokban a fulvosavak a fontosabbak.
A természetes vizek szervesanyag-koncentrációja, tág időközönként változó, a mocsári vizekben (amely magas humuszkoncentráció esetén esetenként eléri az 500 mg/l-t vagy még ennél is magasabb) és a mocsári kocsmákkal rendelkező folyókban a legmagasabb, a mocsárvíz pedig beszennyezte a barna szín 300°-ig és a platina-kobalt színérték skála felett (természetes víz hozzáadása huminsavakat ad). A szerves beszéd-inód magas koncentrációja koncentrálódik benne felszín alatti vizek, ami a benzintartalmú lerakódásokhoz kapcsolódik.Ipari és háztartási szennyvízzel szennyezett természetes vizekben még nagyobb koncentráció is előfordulhat. A szennyezetlen természetes vizek kevés szervesanyag-áramlást okoznak. Például B.A. Szkopincev szerint az óceánvízben a szervesanyag koncentrációja 2,0-5,4 mg/l alá csökken (átlagosan 3,0 mg/l, folyóvízben pedig átlagosan 20 mg/l).
Egyes felszíni vizekben, különösen a mocsarakból származó folyókban, a humuszlerakódások alkotják a víz kémiai összetételének fő részét. A folyók, majd a tavak, tengerek levegőztetése után a víz szerves részei megváltoznak, a talajban pedig az oxidációs folyamat nagyrészt az egyszerű ásványi anyagokról való átállással fejeződik be. A másik, makacs rész elvész és felhalmozódik a víztestekben.
A hideg éghajlati övezetekben (tundrában) nagyon kevés a szervesanyag-felesleg, és ott a víztározók esetleg nem tartalmaznak huminsavat. Az erdők, különösen a tűlevelűek övezetében pedig, ahol bőséges a szerves maradvány, és a bűz nem oldódik ki a felszínen, a huminsavak helyett literenként több tíz milligramm van. A huminsavak nemcsak a tározóban lévő vizet savanyítják, hanem a komplexben szinte minden fontos fémet is megkötnek.
Ha a csapból hideg vizet önt egy palackba és meleg helyre helyezi, gázbuborékok jelennek meg a falakon. Gazit elpusztították hideg vízés hevítéskor láthatóak voltak (hevítéskor a gázok koncentrációja változik). Ez savanyú gáz, nitrogén és szén-dioxid. A vízben lévő gáz intenzitása a hőmérséklet emelkedésével csökken, ami a gázmolekulák kinetikus energiájának növekedésével jár, ami csökkenti a vízmolekulák gravitációs erőit. Minden természetes víz gázforrás. Az oxigén O 2 és a szén-dioxid CO 2 a felszíni vizekben, az oxigén H 2 S és a metán CH 4 pedig a felszín alatti vizekben. Jelentős mennyiségben a CO 2 mélyről is jelen lehet a vízben. Ezenkívül minden természetes víz folyamatosan tartalmaz N2-nitrogént.
Kisen (O 2) törött molekulák megjelenésében megtalálható a természetes vízben. A Kisen erős oxidálószerként kiemelt szerepet játszik a természetes vizek vegyi tárolójának kialakításában. A Kisen a vízből származik a természetben előforduló fotoszintézis folyamatok eredményeként és a légkörből. A Kisent szerves anyagok oxidációjára, valamint az élőlények degenerációs folyamatára használják. Az oldott savanyúság koncentrációja a természetes vizekben 0 és 14 mg/l között változik, intenzív fotoszintézis mellett, ez utóbbiak lehetségesek és magasabbak is. A felszíni vizekben alacsony faktorok miatt tartósan előforduló savkoncentráció miatt koncentrációja jelentősen változik a termelés időtartamával, évszakával és sorsával. Az elhalt savanyúság maradványai a napsugárzás változása miatt nem valószínű, hogy megmaradnak, a fotoszintézis teljes mértékben ettől függ, a nappal előrehaladtával felhalmozódik a savanyúság, és a sötét óra lehetővé teszi ennek fogyasztását. A savanyú a vizekben élő legtöbb organizmus elpusztításához szükséges. Erős oxidáló savként fontos egészségügyi és higiéniai szerepet tölt be, támogatja a szerves feleslegek gyors mineralizációját.
Szén-dioxid (CO2) hogy ő legyen a felelős a vízért, hogy lássa a molekulák CO2-gázzá való bomlását. Ennek egy része (körülbelül 1%) azonban kölcsönhatásba lép a vízzel, szolubilizálva a szénsavat:
CO 2 + H 2 O ↔ H 2 CO 3
Ügyeljen arra, hogy ne adjon hozzá CO 2 és H 2 CO 3, valamint szén-dioxid alatt a legteljesebb mértékben (CO 2 + H 2 CO 3). A természetes vizekben a szén-dioxid a szerves anyagok oxidációs folyamata előtt van jelen, amelyet a CO 2 jelenléte okoz mind a vízben, mind a talajban és a felszínen, amelyen a víz áramlik. Előttük hallható a vízi élőlények lehelete és különböző nézetek a szerves feleslegek biokémiai lebontása és oxidációja. Egyes felszín alatti vizekben fontos szén-dioxid és vulkáni gázforrások találhatók, amelyek a föld felett láthatók, amelyek előfordulása a köpeny gáztalanodásával és az üledékes pórusok összetett metamorfózisával függ össze. az agyag a befolyás alatt magas hőmérsékletű. Ezért a felszín alatti vizekben és az agyagos tározókban gyakran elkerülik a szén-dioxid magas szintjét. A víz által a légkörből kibocsátott szén-dioxid a tengeri és óceáni vizek számára fontosabb, a szárazföldi vizek esetében kevésbé. A szén-dioxid szén-dioxiddal történő helyettesítése a fotoszintézis során keletkezik. Még intenzív fotoszintézis esetén is, ha a gázszerű CO 2 csökken, a maradék ionok láthatók a HCO 3 - ionokból:
HCO 3 - ↔ CO 3 2- + CO 2
A szén-dioxidot a karbonátok lebontására is használják:
CaCO 3 + CO 2 + H 2 O ↔ Ca(HCO 3) 2
Alkalmazzák az alumínium-szilikátok kémiai üvegezését is. A CO 2 változása a vízben, különösen a szárazföldi felszíni vizekben, akkor is megfigyelhető, amikor a légkörbe kerül. Az égő CO 2 atmoszféra nagy jelentőséggel bír a felszíni vizekben található CO 2 számára, amely szabályozza azt. A CO 2 atmoszféra és a CO 2 felszíni vizek között folyamatos csere zajlik, amely a Henry-Dalton törvény alapján egyenlő egyensúly kialakítását irányítja közöttük. A szén-dioxid parciális nyomása a légkörben nagyon kicsi (33 Pa), akkor annak nagy szilárdságától függetlenül (1013 hPa nyomáson és 12 °C hőmérsékleten 2166 mg/l-ig) a mérleg a víz és a légkör között nagyon kevés mu-val érik el a vízben lévő CO 2 -t. A CO 2 parciális nyomása mellett a légkörben 33 Pa, koncentrációja a vízben 2166,0,00033 = 0,715 mg/l (12 °C-on). A talaj felszíni vizei miatt, amelyekben a szerves anyagok és a talajok különböző bomlási folyamatai zajlanak, nagyobb mennyiségű CO 2 megy végbe, és ezért kerül ki a légkörbe. Ha a fotoszintézis nem nagyon erős, ha CO 2 van jelen, a CO 2 eltávolítható a légkörből. A természetes vizekben a szén-dioxid helyett rendkívül változó - akár több tizedszeres 3000-4000 mg/l-ig. A legalacsonyabb CO 2 koncentráció a felszíni vizekben, különösen az ásványosodott vizekben (tenger, sós tavak), a legmagasabb a felszín alatti és szennyezett szennyvizekben. Folyókban és tavakban a CO 2 koncentráció ritkán haladja meg a 20-30 mg/l-t.
Rozchinny molekuláris nitrogén (N 2)- A legstabilabb gáz a természetes vizekben. A kémiailag legstabilabb és biológiailag legfontosabb nitrogén, amely az óceánba vagy a felszín alatti vízbe kerülő agyaggolyókba kerül, csak a fizikai erők (hőmérséklet és nyomás) beáramlása hatására változik gyorsan. A felszíni vizek esetében a nitrogén fontos szerepet játszik a vízellátásban. A természetben a biogén nitrogén mennyisége széles körben megnövekszik, ami a denitrifikáció eredménye.
Gáz metán (CH4) eléri a legnagyobb gázokat és a felszín alatti vizeket. A talajvíz gázfázisában gyakran a nitrogén, a szén-dioxid vagy a metán van túlsúlyban. A metánképződés fő forrása a kőzetekben diszpergált szerves vegyületek. A szénhidrátokban fontos metán gyakran jelentős koncentrációban fordul elő a benzintartalmú lerakódásokhoz kapcsolódó zárt szerkezetek mély felszín alatti vizeiben. Alacsony koncentrációban a metán felhalmozódik a természetes tavakban, ahol az öszvérből látható, amikor magas fákat telepítenek, valamint az óceán fenekén lévő lerakódásokban a magas biológiai termelékenységű területeken.
Gáz Sirkovoden (H 2 S) A fehérjetartalmú anyagok bomlásának egyik terméke, amely az Ön raktárában raktározódik, ezért felhalmozódását a különféle szerves feleslegek rothadása miatt gyakran vizes fenékgolyókban tárolják. A mély tavak és tengerek alsó részein, ahol napi vízcsere van, gyakran mélyvízi zóna alakul ki. Ha a víz parciális nyomása a légkörben nulla alatt van, a víz jelenléte a felszíni vizekben lehetetlen. Ezenkívül a bort savasság oxidálja, amelyet a víz felold. A folyókban a mélyvíz főleg a fenékmedencékre korlátozódik, különösen a téli időszakban, amikor a víztest levegőztetése nehézkes. A vizes víz jelenléte a természetes, nem szennyezett felszíni vizekben ritka jelenség. A víz sokkal gyakrabban van jelen a felszíntől elzárt felszín alatti vizekben és az erősen szennyezett felszíni vizekben, ahol a borok a súlyos szennyeződés és az anaerob vízelvezetés indikátoraként szolgálnak.
A vízben lévők mellett számos elem: nitrogén, foszfor, szilícium, alumínium, nyál, fluor 0,1-10 mg/l koncentrációban van jelen. A bűzt mezoelemeknek nevezik (a görög „Mesos” szóból - „középső”, „köztes”).
A nitrogén nitrátok formájában NO 3 - elvész a vízben és az asztali vízben, valamint aminosavak, sók (NH 2) 2 CO és ammóniumsók NH 4 + - formájában a szerves feleslegek ártalmatlanítása során.
A foszfor a vízben hidrofoszfátok HPO 3 2- és dihidrogén-foszfátok H 2 PO 3 formájában van jelen -, amelyek a szerves feleslegek lebomlása következtében jönnek létre.
A szilícium a természetes vizek vegyszertárolásának alapvető alkotóeleme. Ez annak köszönhető, hogy a hegyvidéki kőzetekben szilícium jelenlétében mindenhol más komponensek is jelen vannak, és a fennmaradó komponensek csekély változatossága magyarázza az ivóvíz minimális szilíciumtartalmát. A szilícium koncentrációja a természetes vizekben néhány milligramm/1 liter. A felszín alatti vizekben emelkedik, és gyakran tíz milligrammra csökken 1 literenként, forró termálvizekben pedig akár százra. A szilícium érzékenységét a hőmérséklet mellett erősen befolyásolják a pH-eltolódások. A felszíni vizekben kis mennyiségű szilícium található, amely szilícium-dioxiddá redukálódik (26 °C-on 125 mg/l, 38 °C-on 170 mg/l), jelezve a vízben a koncentrációját megváltoztató folyamatok jelenlétét. Előttük szilíciumban gazdag vízi élőlényeket kell bevezetni, amelyek közül sok, például kovamoszat alkotja majd szilíciumvázát. Ezenkívül a kovasav, mint gyenge sav, különbözik a szénsavtól:
Na 4 SiO 4 + 4CO 2 + 4H 2 O = H 4 SiO 4 + 4 NaHCO 3
Csökkenti a szilícium instabilitását a szilícium géllé alakulására való hajlam miatt. Nagyon kevés ásványos vizekben a szilícium forrássá válik, és néha a víz kémiai összetételének fontos részévé válik, egyáltalán nem számít. A szilícium jelenléte a vízben komoly technológiai hiba, hiszen amikor a forrásban lévő víz teljesen kiszárad, a szilícium nagyon kemény szilikátréteget hoz létre a kazánokban.
Az alumínium az agyagon (kaolinon) lévő savak miatt víz közelében van jelen:
Al 2 (OH) 4 + 6H + = 2SiO 2 + 5H 2 O + 2Al 3+
A fő lelőhely agyag. A szerves maradékok (a továbbiakban: „C”) velük érintkezve két vegyértékűre redukálják a tartalmat, amely hidrokarbonát vagy huminsavsók formájában teljesen felszívódik:
2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 = 4Fe(HCO 3) 2
Amikor a víz oldott Fe 2+ ionokkal érintkezik vízzel, az gyorsan oxidálódik, és barna Fe(OH) 3 hidroxid csapadék képződik. Ebben az évben mocsári ércvé alakítják át - barna gyom (limonit) FeO(OH). A bélés kitermelésére a 18-19. században kitermelték a karéliai mocsári ércet.
A víz felszínén lévő kék köpet a Fe(OH) 3, amely feloldódik, amikor a felszín alatti, Fe 2+ -ionokat tartalmazó víz érintkezik a felszínnel. Gyakran elvesznek a polietilén olvadékban, de nagyon könnyű szétvágni őket: a hidroxid olvadék begyógyítja a leszakadt széleket. Miután a folyadék a víz felszínére került, nyomja ki a hidroxid olvadékot egy olajteknőbe, hogy ne folyjon túl.
Ebbe a csoportba tartoznak azok az elemek, amelyek a természetes vizekben nagyon kis koncentrációban találhatók meg, ezért ezeket mikroelemeknek nevezzük. Koncentrációjuk mikrogramm/1 literben (mcg/l) változik, és gyakran nagyobb értékeket mutat. A mikroelemek a természetes vizek kémiai összetételének legnagyobb elemcsoportját alkotják, ide tartoznak a periódusos rendszer minden olyan eleme, amely nem szerepelt az előző komponenscsoportokban. Mentálisan öt alcsoportra oszthatók: 1) tipikus kationok (Li +, Rb +, Cs +, Be 2+, Sr 2+, Ba 2+ és így tovább); 2) fontos fémek ionjai (Cu 2+, Ag +, Au +, Pb 2+, Fe 2+, Ni 2+, Co 2+ és így tovább); 3) amfoter komplexek (Cr, Mo, V, Mn); 4) tipikus anionok (Br-, I-, F-); 5) radioaktív elemek. A mikroelemek szükségesek a növények, állatok és emberek normális életéhez. Megnövekedett koncentráció mellett azonban számos mikroelem káros és káros az élő szervezetekre. Ezért a bűz gyakran sáros hangokká olvad, és koncentrációjuk kontrollált. A mikroelemek sikeres termesztését nehezíti a természetes vizekben való csekély jelenlétük, illetve a vizekben való jelenlétük formájának nagy bizonytalansága. Továbbra is nehéz megmagyarázni migrációjuk és rendszerük mintáit, és nehézségeket okoz a kémiai elemzésben. Például sokat fontos fémek Nagy koncentrációban a létfontosságúba vándorolnak, és nem a rendezetlen állapotba. A szétesett szerves komplexek létrehozzák a legtöbb fémet, mindenekelőtt a háromértékű fémeket humin- és fulvosavakkal. A komplexált fémek koncentrációját a szerves savak koncentrációja előtt számítjuk ki. A kőzetek megjelenése fém-hidroxidokban gazdag. Lehetséges, hogy a kolloidok felületén szerves anyagok adszorpciója következik be, ami nagyobb stabilitást biztosít a lebontásban.
Vegyi raktár a természetes víz tehát az előző történelmet jelenti. a víz által keringése során kialakított utak. Számos különböző beszéd van lerakva az ilyen vízben, egyrészt ezeknek a beszédeknek a raktárából, amelyekkel ez folyt, másrészt az elmékből, amelyekkel kölcsönhatásba léptek egymással. A következő tényezők adhatnak vizet egy kémiai tározóhoz: hegyvidéki kőzetek, talajok, élő szervezetek, emberi tevékenység, éghajlat, domborzat, vízjárás, növényzet, hidrogeológiai és hidrodinamikai viszonyok stb. Nézzük meg közelebbről a víztárolóba áramló tényezőket.
A talajon átszűrt talajpusztulás és légköri csapadék a kőzetek és ásványi anyagok lebomlását eredményezi. Ez az egyik legfontosabb befolyás a talajra, amely a természetes vizek öntőraktárába áramlik, aminek következtében megnövekszik a szén-dioxid koncentrációja a talajban, ami az élő szervezetek és gyökérrendszerek talajban történő kiszáradása és biokémiai lebomlása során tapasztalható. szerves többlet. Ennek eredményeként a talajlevegő CO 2 koncentrációja 0,033%-ról, a légköri levegőben a talajlevegőben 1%-ra vagy többre nő (fontos agyagos talajokon a CO 2 koncentráció a talajlevegőben A szél eléri az 5. -10%, ezáltal a fajták életkorának megfelelő erős agresszív fellépést biztosítanak). Egy másik tényező, amely fokozza a talajon átszűrt víz agresszív hatását, a szerves anyag - a talaj humusza, amely a felesleges növényzet átalakulása során képződik a talajban. A humusznak az aktív reagensek tartályában történő tárolásánál először meg kell neveznünk a humin- és fulvosavakat, valamint az egyszerű anyagokat, például a szerves savakat (citromsav, sóska, oxtoe, almasav stb.). A szerves savakban és CO 2 -ben gazdag talajbányászatot gyakran felgyorsítja a talajban található alumínium-szilikátok kémiai üvegezése. Hasonlóképpen, a talajon átszűrt víz felgyorsítja a talaj alatti alumínium-szilikátok és karbonát kőzetek kémiai rezgését. A Vapnyak könnyen oldja az alacsony minőségű (akár 1,6 g/l) kalcium-hidrokarbonátot:
CaCO 3 + H 2 O + CO 2 ↔ Ca(HCO 3) 2
Oroszország egész európai részén (Karélia Krím-félszigete és Murmanszk régió) a lerakódások, valamint a dolomit MgCO 3 .CaCO 3 a felszín közelében fekszenek. Ezért fontos, hogy az itteni víz kalcium- és magnézium-hidrokarbonátot tartalmazzon. Az olyan folyókban, mint a Volga, Don, Pivnicsna Dvina és ezek fő befolyása, a kalcium- és magnézium-hidrokarbonát az összes oldott só 3/4-9/10-ét teszi ki.
A sókat a víztestekből és az emberi tevékenység eredményeként fogyasztják. Tehát az utakat nátrium- és kalcium-kloriddal szórják meg, hogy megolvadjon a jég. Tavasszal a folyónál olvadékvízből kloridok folynak össze. Oroszország európai részének folyóiban a kloridok mennyiségét emberek vitték oda. A folyók közelében, amelyeken nagyszerű helyek állnak, ez a rész gazdagabb.
A helység domborzata közvetve egy víztározót tölt be, elnyeli a sók talajból való eltávolítását. A folyó eróziós bemetszésének mélysége megkönnyíti az ásványosabb talajvízzel való folyó elérését az alsóbb horizontokról. Ki tud befogadni más típusú depressziókat (folyóvölgyek, szakadékok, szakadékok), amelyek javítják a vízgyűjtő vízelvezetését.
Az éghajlat fülledt hátteret teremt, ami lehetővé teszi, hogy a természetes vizek kémiai tározójának kialakulásában több folyamat lejátszódjon. Az éghajlat elsősorban a hő és víz egyensúlyától függ, amely meghatározza a talaj lerakódásait és a vízhozam mennyiségét, így a természeti zavarok felhígulását vagy koncentrációját, valamint a folyók pusztulásának vagy ostrom alá kerülésének lehetőségét.
Nagyon fontos, hogy a víz vegyi raktárát egy nagy áramlásba hozzuk, és idővel megváltoztassuk a víztest életét és kapcsolatát. A hóolvadás időszakában a folyók, tavak és tározók vize alacsonyabb mineralizációjú, abban az időszakban, amikor a legtöbb élet a talajvízből és a felszín alatti vizekből származik. Ezért használják a bútorokat a víz felszínének szabályozására és a víz eltávolítására. A lefolyó medencék rendszerint a tavaszi szezonban feltöltődnek, ha az árapály víz kevésbé mineralizált.
A víz kémiai tárolása eltérő lehet, szervetlen és szerves anyagok részecskéi helyén töredékek helyezkedhetnek el. A föld különböző részein átfolyva a víz lebontja a bennük lévő sókat (kalcium, magnézium stb.).
A föld felszínén forogva a víz felhalmozódik a gázokkal, feloldva azokat. A természetes vizeket a vegyszerraktártól egyféleképpen választják el, így gázok, bázikus ionok, biogén és szerves anyagok, mikroelemek alkotják.
Nagy mennyiségű víz- és vegyszertárolás kerül a talajra és a mederre. A víz eltávolítja az ásványi és szerves anyagokat a talajból, amelyet az üzemelés első szakaszaiban különösen gondosan őriznek.
A természetes és mesterséges tározókban a gázrendszer a légkörből és a kémiai folyamatok eredményeként elveszett gázok kombinációjával jön létre. A hőmérséklet, a nyomás és a vízben lévő sók jelenléte miatt nagyszámú oldott gáz marad vissza.
Ezek a gázok, és mindenekelőtt a savasság és a szén-dioxid, egyszerűen szükségesek a vízi élőlények életéhez. Minél többen vannak a víz közelében, annál jobb a vízgyűjtőben élőknek. A magas víz-, metán- és nitrogéntartalom azonban csökkenti az élőlények vitalitását.
Az egyik legfontosabb gáz, amely folyamatosan jelen van a felszíni vizekben, a savanyú gáz. A kémiai-biológiai vizekben jelentős mennyiségű víz található.
A fej dzhereleket savanyú vízzel töltik
- a légkör - a feltámadó szél alatt összeolvad a felszíni vízgolyókkal;
- Mikroszkopikus algák fotoszintézise.
Magas hőmérsékleten a víz savassága megváltozik, alacsony hőmérsékleten pedig megnő.
A természetes vizekben a víz savassága 100% alatti, mivel ennek a gáznak a térfogata szerves anyagok oxidációjába megy el. Ha nagy víztömegekben (télen) tömegesen fejlődnek algák, a savanyúság elérheti a 150-200%-ot.
A szén-dioxid (CO 2) minden természetes vízben nagy mennyiségben jelen van. Ebben az esetben a legtöbb szén-dioxid oldott állapotban van jelen, és kis mennyiségű szén-dioxid (legfeljebb 1%) kölcsönhatásba léphet a vízzel, és szénsav keletkezhet.
A szénsav koncentrációjának növelése a keverékben az optimális szintre a szerves anyagok koncentrációján alapul. Különösen fontos a savasság és a szénsav termelésének szabályozása.
A víz kémiai összetételének, változásának jellegének meghatározásához laboratóriumi vizsgálatokat kell végezni. A víz savasságára vonatkozó alapvető információkat egy speciális vizsgálati eszközzel lehet megszerezni. átlátszó blokk két árokkal és színskálával.
Ezen és más vegyi anyagok jelenlétében a vizsgált víz külön színt fejleszt, amely igazodik a skála színskálájához. A bőr színskáláját a víz savasságának mértéke határozza meg.
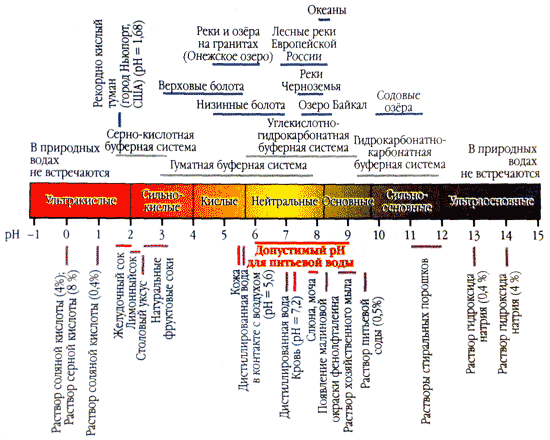
A víz savassága (pH) a közeg aktív reakcióját jellemzi. Minél közelebb van a pH érték a nullához, annál nagyobb a vízionok koncentrációja az oldatban, annál savasabb a közepe.
A víz savasságának optimális mutatója az ember számára a szűk 7,2-7,4 tartományban van, maximum 7,6. Ilyen egyenlő pH mellett a víz nem folyik az emberi bőrre, és megakadályozza a mikroorganizmusok elszaporodását.
Ha a pH-érték magasabb, mint 7,8, az ilyen víz irritálja a bőrt (különösen érzékeny), és a mikroorganizmusok könnyen szaporodhatnak a vízben. Továbbá, magas rebarbara A pH elősegíti a víz maró hatását, ami jelentősen befolyásolja a birtoklás és a kommunikáció hatékonyságát.
A víz pH-értékének legmagasabb szintje (8-8,8) a tenyészidőszak másik felében figyelhető meg, amikor az alga biomassza eléri a legnagyobb kifejlődését, és a fotoszintézis folyamatok maximális intenzitással mennek végbe.
Kémiai reakciók eredményeként, mint a víz. A pH-érték fokozatosan változik, mind a vízzel, mind a felvett vízzel.
A víz keménysége nagymértékben befolyásolja a pH-értéket. Igen, y lágy víz A rebarbara pH-ja 7,0 alatt van, a keserűé pedig elérheti a 9,0-t.
Ca CO2 () helyett a víz keménységét határozzák meg. Hőmérsékletváltozás esetén üledék hullik a medence falaira, a szűrőkre, hőcserélőkre és egyéb berendezésekre.
A szabványok szerint a víz keménysége nem haladhatja meg a 30°dH-t, ahol 1°dH = 10 mg CaO/l. A víz keménysége változhat, ha hosszú ideig áll. Télen az esős évszakban tovább csökken.
A víz oxidációját különféle szerves és ásványi anyagok felhasználása határozza meg.
Az oxidáció mértéke azt mutatja meg, hogy mennyi oxidáció megy el a szerves anyagok megsemmisítéséhez (mg/l). A jelenlegi tenyészidőszakban a víz oxidációja 10-ről 30 mg-ra változik 1 literre vagy még többre.
Vegyi víz raktár. A természetben gyakori, hogy a víz mindig több vagy kevesebb ásványi sót tartalmaz. Lépés ásványraktár A víz mennyiségét a víztartókba vagy felszíni víztározókba lefekvő talaj vagy talajok jellege határozza meg.
Az ásványi sók mennyiségét, akárcsak a vizet, mg/l-ben fejezzük ki.
Organikus beszédek. Ezek közül a legfontosabbak a lény utazásának szavai, a bűzfoszlányok különféle kórokozó mikrobákat tartalmazhatnak. Ezen anyagok vízben való jelenlétének vagy jelenlétének közvetett higiéniai mutatója a víz oxidációja.
A víz oxidációja. Az 1 liter vízben található savanyúság mennyisége (mg), amelyet a szerves anyagok külső oxidációjára fordítanak (mg/l). Minél kisebb a savasság mennyisége a vízben, annál kisebb a savasság az oxidáció felületén 1 liter vízben szerves vegyületekkel. Például a tiszta talajvíz oxidációja nem haladja meg a 2-4 mg/l-t, a folyóvízé nem haladja meg a 7 mg/l-t.
A szerves savak vízben való esetleges jelenlétének egyik mutatója a benne oldott savasság mennyisége (mg). A tiszta vizekben 3-6 mg/l savanyú víz szabadult fel, a szennyezett vizekben pedig jóval kevesebb, amíg teljesen el nem tűnt.
Ammónia, salétromos sók és salétromsavak jelenléte figyelhető meg ammónia, salétromos sók és salétromsav jelenlétében. Az ammónia egy termék cob szakaszok a főzés során keletkező szerves hulladékok rothadása, a salétromsav és a salétromsav sói pedig a szerves hulladékok mineralizációjának végtermékei. Nyilvánvaló, hogy a víz hosszú időre elzáródott.
A sósav és a savas savak sóinak jelenléte a vízben a víz állatok és emberek ürülékével való lehetséges szennyeződésére utal (fekális szennyeződés). Tegyük fel, hogy 1 liter tiszta természetes víz valamivel több, mint 20-30 mg kloridot tartalmaz.
A víz keménysége. Kalcium- és magnéziumsók helyett javasolt. Osszuk fel a vizet apró darabokra, egyenként. Látható a víz természetes keménysége - a szürke víz keménysége, a fajlagos keménység, amely forráskor vagy álláskor változik, és nem túlcsordul, ami nem csökken a víz forrása után.
A zöldségeket és a húsokat rosszul főzik kemény vízben, mert a bennük található fehérjék kalciummal és magnéziummal olyan szervetlen anyagokká keverednek, amelyek nem szívódnak fel az emberi belekben.
Az ilyen víz nem alkalmas higiéniai eljárásokra: túlzott mennyiségű sókat tartalmaz, amelyek túlcsordulnak, és a nemkívánatos maradványok lerakódnak a hajra, és mit képeznek.
Az ivóvíz keménysége meghaladhatja a 7 mg/l-t. Ez a jellemző fokokban fejezhető ki (1 mg/ekvivalens vízkeménység egyenlő 2,8°-kal). A kemény víz 20°-nál nagyobb, a lágy víz 10°-nál kisebb.
Sókat öntünk. A kiömlő víz nem olcsó, de számtalan mennyiségben keserű fémes ízt és sárgás vagy sárgásbarna aromát kölcsönöz, csökkentve a tisztaságot. Az ivóvíz legfeljebb 0,5 mg/l (hideg víztestekben) és 1,0 mg/l (felszín alatti víztestekben) megengedett.
Fluor. Bármi is van az ivóvízben, az jelentősen ráfolyik a fogakra. A koncentráció növekedésével fluorózis lép fel (sötét foltok megjelenése a fogzománcon), ami további szuvasodáshoz vezet, ha pedig nem elegendő a fogszuvasodás, a fogszuvasodás gyakoribbá válik. A víz legfeljebb 1,5 mg/l fluort tartalmaz, az optimális savtartalom 0,7-1,0 mg/l. Ha a fluort nem távolítja el, a vizet külön kell fluorozni, és nátrium-fluoridot kell hozzáadni.
A természetes (földi) víztestekben természetes öntisztulási folyamatok zajlanak, mivel az ember nem tudja leküzdeni ezeket:
* Ultraibolya sugárzástól mentes;
*Fontos részecskék ülepítése és elválasztása;
*Szerves anyagok O2-tartalom miatti oxidációja;
* A baktériumok szaporodása miatti szerves feleslegek mineralizációja.
1. oldal
A folyóvíz tárolását a talajból és a szélből befolyó patakok mennyisége és erőssége, valamint az ipari és önkormányzati vállalkozások szennyvize határozza meg.
A folyami víztározók osztályozása az ábrán látható. A 3.24 leegyszerűsített, és nem mindig bizonyul hatékonynak.
Amint azt a folyóvíz tárolására vonatkozó kiterjedt kutatások kimutatták, a tárolótartályból történő vízkibocsátás szabályozása nem igényel annyi jelentős változtatást, amennyit a folyóvíz elvégezhet. jelenlegi módszerekkel elemzés.
A szezonális sajátosságok miatt a folyóvíz tárolásában bekövetkezett változásokat a telepítési tervezéskor vissza kell állítani. A fontos kationok bőrosztálya három csoportra osztható: kalcium, magnézium és nátrium. A bőrcsoport a maga módján négy víztípusra oszlik, amelyeket számos ion azonosít. A krém fontos kationokat tartalmaz, a folyóvíz K, NH4, Fe2, Mn2, Cu2, Zn2, Ni2, Fe3, Al3 ionokat és kisebb koncentrációban számos egyéb iont tartalmaz.
A teljesítményváltozás természetének és a folyóvíz áramlásának megértéséhez a benzintartalmú képződmények mentén, 1957-ben. A TatNIPInafta fúrói öt befecskendező fúrót fúrtak önállóan.
Közeli települések Az ipari szennyvíz pedig nagy mennyiségű ipari szennyvizet képes ellátni a folyóvízraktárba.
Útmutatás a táblázatból. 3 ábra mutatja, hogy a folyóvíz tárolása széles határok között változik. A termékeny területeken átfolyó folyóvizek tele vannak karbonátokkal és magas kalciumtartalommal. A száraz területeken átfolyó folyóvizek (például az Egyesült Államok nyugati részén) több szulfátot, kevesebb kalciumot és így karbonátot tartalmaznak. Helytelen lenne figyelmen kívül hagyni a vizek által szállított szerves folyadék mennyiségét, amelynek töredékei benzinné alakulnak.
A felszín alatti vizek vegyszeres tárolása a part menti víznyelőknél más szóval a folyóvíz tárolása, amely a maga módján légköri csapadéktárolónak, valamint hó, vihar és felszín alatti lefolyás tárolójának van kijelölve. A légkörben felhalmozódik az esővíz és a hó nagy mennyiség savasság, szén-dioxid, nitrogén-oxid, ammóniumsók, és az ipari területek szennyezett környezetében, ahogyan az anyagot értjük, fűrészport, baktériumokat, szirupot, szén égéstermékeit, benzint és egyéb anyagokat adnak hozzá.
Emiatt a folyó közelében csekély mennyiségű akadályozott szennyvíz folyik, ami a kifolyó folyóvíz tárolójának kimerülését eredményezi, ami kizárja a további felszámolás lehetőségét.
A bűz ásványi anyagok formájában koncentrálódik, például gipsz Ca8O4 - 2H2O, mirabilit Na28O4 - 10H2O, és belép a tengeri és folyóvíz tárolójába is.
A felső folyóvizekre (valamint a tavakra és vizekre) jellemző a tározók bősége, ami a víz közelében lévő növények és élőlények életéből, valamint a fő esemény a tavaszi áradásokból és a vízből kimosódó deszkákból adódik. jelentős számú talajrészecskét partoz. Ugyanakkor a lakott területek közelében az ipari vállalkozások szennyvíz-kibocsátása és hulladéka gyakran beömlik a folyóvíztároló területre.
A folyóban található vegyszerraktár felismeri a szezonális ingadozásokat. A folyóvíz legnagyobb mineralizációja abban az időszakban következik be, amikor a folyó talajvízzel él, a legkevésbé pedig az esős évszaknak vagy a jégtakarók életének köszönhető. A folyóvizek tárolása a fizikai-földrajzi elmék kezében van. A föld feletti zónákban a víz mineralizációja alacsony. Az ásványosodás is megváltozik, ahogy a folyó befolyik a befolyóba, a vízbevételbe, amely más öntőmedencékben található.
A folyóvíz, valamint a hulladék tárolását az idők végezetéig tárolják. A legkevesebb iszaposodás és a legnagyobb ásványosodás télen fordul elő, árvizek idején viszont, különösen tavasszal, fordítva. A sors idején meteorológiai lefolyások, nyári szelek és egyéb tényezők ömlenek a folyóvízraktárba.
A természetes vizek vegyszerraktára nagyon összecsukható. Több családjuk van kémiai elemek, amelyeket grammos részekben vagy egészben, sőt több tíz vagy száz grammban számolnak literenként vízben. Ezek a vízben található elemek és az ionok vagy molekulák megjelenése, amelyek összetett szerkezeteket hoznak létre, beleértve a szerveseket is.
A víz mineralizációjának szakaszát és jellegét ezen és más helyeken a víz megzavarja. A vízben a nem repülő ásványi és részben szerves anyagok lebontása helyett a száraz felesleg mennyiségét (fő mennyiség, kloridok, szulfátok, karbonátok és bikarbonátok összessége, réti és réti-földi fémek) jellemzik. A nagy mennyiségű ásványi sókat tartalmazó vizek kellemetlen sós vagy keserű-sós ízt kölcsönözhetnek, így a száraz ivóvízfelesleg mennyisége a folyóvíz zamatos erejére való beáramlása miatt egészségügyi gyakorlat alá tartozik. akár 1000 mg /l. Kísérleti vizsgálatok kimutatták, hogy az optimális (érzékszervi tulajdonságok) a tápláló víz, amely literenként 200-400 mg sókat tartalmaz. A legfeljebb 1000 mg/l száraz feleslegű vizet frissnek, 1000 mg/l felett pedig mineralizáltnak nevezzük.
A víz elsődleges mineralizációs szintjében bekövetkezett változások, amelyek nem természetes okokra vezethetők vissza (tavaszi árvizek), a külső folyók vízszennyezésének jeleként tekinthetők.
A vízben lévő kloridok különösen nátrium-klorid és legalább más vegyületek (magnézium-klorid stb.) formájában koncentrálódnak. A természetes vizekben a kloridok a talajképződményekből való eltávolításuk eredményeként jelennek meg. A szikes talajú területek különösen gazdagok kloridokban. A kloridok fontos anyagok, amelyek megváltoztatják a víz ízét és befolyásolják a szervezet élettani funkcióit. A kloridok 500 mg/l koncentrációtól kezdődően elnyomják a csigakiválasztást, ami a mérgező csigalé savasságának és erősségének változásában tükröződik. Ennek eredményeként felgyorsul az élet evakuálása a hajóról. 1000 mg/l-nél nagyobb koncentrációban a klorid a diurézis megváltozásához vezet, ami különösen káros lehet a szívbetegségben és egészségügyi problémákban szenvedők számára. 350 mg/l klorid koncentráció felett adjunk hozzá sós vizet az elegyhez.
A kloridok elveszhetnek a vízben ürülékből, dugványokból, konyhai hulladékból, kommunális vízellátáshoz, szennyeződésre nem érzékeny vízhez, a kloridok fontosak lehetnek a mindennapi vízszennyezettség közvetett indikátoraként. Akinél nem mérik fel a kloridkoncentrációt, mennyi a változás a víz órájában és szakaszában, akkor. vészhelyzeti, természetes koncentrációval szembeni növekedés. A kloridok és ammónia erős jelenléte a magas oxidációjú és kellemetlen bakteriológiai mutatókkal rendelkező növényekben ennek a víznek az egészségügyi problémáit jelzi.
A szulfátok 500 mg/l-t meghaladó mennyiségben, vizes-sós kortyot adnak a vízhez, 1000-1500 mg/l koncentrációban, és nagy valószínűséggel elnyomják a nyálkahártya szekrécióját, hashajtó hatásúak a belekben, és negatív attitűd az emberek ízléséhez.öntözze meg a jakját. A szulfátok jelezhetik a felszíni vizek állati ürülékkel való szennyezettségét, hiszen a fehérjetestek tároló része a kén, amely lebomlása és további oxidációja során kénsavsóvá alakul.
A víz keménysége a kétértékű fűfém-kationok koncentrációját mutatja meg benne, elsősorban a kalcium és a magnézium. A Ca(2+) és Мg(2+) ionok különböző anionokhoz köthetők (HCO 3, SO 4, Cl, CO 3, HNO 3 stb.).
A kalcium- és magnézium-hidrokarbonátok Ca(HCO 3) 2, Mg(HCO 3) 2 és a karbonátok CaCO 3, MgCO 3 jelzik a karbonátkeménységet. A víz melegítése során a karbonát keverék megsemmisül (2-re változik), ennek eredményeként a szénhidrogének karbonátokká alakulnak.
A kalcium- és magnézium-karbonátok közötti különbség lényegesen kisebb, mint a szénhidrogéneké, ezért forrásban lévő vízzel a keménység csökken. A kalcium- és magnézium-hidrokarbonátokból álló víz keménységét karbonátnak nevezzük. A karbonát keménységet gyakran kombinálják a hagyományos keménységgel, de lehetetlen őket egyenként egyenlővé tenni. Magas vízben lévő magnézium-hidrokarbonát koncentráció esetén a karbonát és a hagyományos keménység közötti különbség jelentős lehet. A relatív keménység értéke gyakorlatilag elkerüli a víz nedvességtartalmát, amely a talajfémek (Ca, Na, Mg, K) és egyéb gyenge savak sóit tartalmazza. A víz nedvességtartalma fontos a víz alvadási folyamatában a tisztítás során. A jogi és a hagyományos kegyetlenség közötti különbséget ún állandó kegyetlenség, nagy mennyiségű kalciummal és magnéziummal társul, a szénhidrogéneken kívül más anionokkal is (Cl, SO 4, NO 3 és így tovább).
A víz keménysége az ivóvíz keménységének egyik alapvető kritériuma. A kemény víz nem alkalmas kormányzati célokra: a zöldségeket, a húsokat és a szárnyasokat kemény vízben főzik meg. külső megjelenés, a tea íze és édessége, édesen inni nem árt, hiszen a benne lévő nátriumot a vízben kalcium és magnézium helyettesíti, aminek következtében kalcium és magnézium tartalmú üledék keletkezik. A kemény víz betegséget és száraz bőrt okozhat; A melegvíz-ellátó rendszerek fűtőberendezéseiben a kemény víz kisebb hordalékot képez, ami megnehezíti a működésüket.
Ami az egészséget illeti, a magas keserűség az urolithiasis kialakulásához hozzájáruló egyik tényezőnek tekinthető, amint azt fentebb említettük. A következő három órában a táplálkozásról lesz szó, annak érdekében, hogy a falánkságot beépítsék a szív- és érrendszerbe; Vannak adatok a szívbetegségek miatti halálozási arányról az üdítővíz fogyasztása miatt. Ezt a hipotézist sok országban nem erősítették meg.
Bejut a létrehozott szervezet láthatatlan részébe, és a dikolikus enzimek (hemoglobin, kataláz stb.) stimulálására szolgál. Látható, hogy a beleken keresztül elhagyja a testet. A test a helyiségben lévő szükségleteit elsősorban úgy elégíti ki, hogy együtt él a környezetével, vagyis mekkora méretű bejutni a szervezetbe. vizet inni, nincs valódi élettani jelentősége. Fe(2+), Fe(3+) felszabadulás minden természetes vízben változó koncentrációban előfordul. Magas koncentrációban a víztestekben az eredmény szennyvíz összegyűjtése. Ha a vizet acél (nem horganyzott) csövön keresztül osztják el, ahelyett, hogy bejutna, a korrózió fokozódik. A lenyelés szervezetre gyakorolt mérgező hatása nem ismert. Orális adagolás esetén nagyobb dózisokat (300 mg/kg vagy nagyobb) alkalmaztak a mérgezés jelei nélküli gastroenteritis megelőzésére. Ezért a víz jelenléte a víz közelében nem az esztétikai és mindennapi irritációnak köszönhető, így kalamutnost, előkészítést és keserű fémes ízt ad a víznek. Ezenkívül a vízben megnövekedett sótartalom elősegíti a nyálbaktériumok fejlődését, amikor a vízvezetékek kihalnak, nehéz üledék halmozódik fel, ami megváltoztatja átmérőjüket. Megállapítást nyert, hogy savas és oxidos folyadékok infúziója során a víz átlátszósága és színe fokozódik, és a bűz minden esetben a folyadékban lévő hidroxid miatt következik be. Ha a víz koncentrációját 0,3 mg/l-re változtatjuk, a víz tisztasága és színe megegyezik a standard értékkel. A víz fémes íze 0,5 mg/l koncentrációban jelenik meg. A lakossági kísérletezés módszere alapján jól látható, hogy lényegesen nagyobb infúziós kapacitással (1,0 mg/l felett) a víz különféle hatásokat válthat ki az ember bőrén, beleértve a viszketést, kiszáradást.
Ahhoz, hogy a víz színét a kívánt szabványra hozzák, speciális módszereket alkalmaznak a víz színének színezésére a víztisztító telepeken. A szulfátok, kloridok és egyéb sók vízben való helyettesítésére a vizet sótalanítják különböző sók további hozzáadásával. A sótalanítás desztilláció, ioncsere és elektrodialízis módszereivel történik. A helyi vízellátás tudatában a természetes hideggel történő fagyasztás és a darabos fagyasztás módszere érvényesül.
A víz fertőtlenítésére a következő módszereket alkalmazzuk: levegőztetés (oxidáció) és a folyadékból eltávolított további extrahált hidroxiddal történő áztatás állással és szűréssel, valamint a víz vikorista koagulálása és kationizálása.
A víz lágyítására (a Ca(2+) és Mg(2+) vízkationok végleges vagy részleges eltávolítására reagens módszereket alkalmaznak, amelyek a víz kezelésén alapulnak olyan reagensekkel, amelyek kalcium és magnézium ionokkal kombinálva gyakorlatilag nélkülözhetetlen anyagokat vesznek ostrom alá. (Ezért szükséges az eloltott gőz hozzáadása szódával kombinálva). Praktikusabb Elfogadva az ioncserélő módszert is az ioncserélő gyantákból származó víz lágyítására. A vízlágyítás ioncserélő módszerrel történhet N-kation fürdővel, H-kationos fürdővel, párhuzamos vagy azt követő N-Na-kation fürdővel.
A víz egészségügyi-kémiai elemzésében fontos szerepet játszik az ammóniasók, nitrogén- és salétromsavak (nitritek és nitrátok) koncentrációja, amely a víz szerves hulladékokkal való szennyezettségének közvetett mutatója.
A vízben található, teremtett természetű szerves anyagok lebomlanak, és a vízben élő mikroorganizmusok jelenléte miatt mineralizálódik. Ez a folyamat intenzívebben megy végbe meleg időben és a vízben lévő sav miatt. A nitrogéntartalmú szerves anyagok mineralizációja két fázisban megy végbe. Az első fázisban, amelyet amonifikációnak neveznek, a fehérjék és anyagok aminosavakra és sókra bomlanak. A fehérjék lebontása anaerobok (B. putrificus, B. sporogenes és mások), fakultatív anaerobok (B. micoides és mások) és aerobok (B. mesentericus, B. subtilis és mások) beáramlása alatt megy végbe. A mag amonifikációját urobaktériumok és mikrobák okozzák. Az ammónia maradványai egy csutkatermék, amelynek jelenléte friss szerves erjesztett vízről beszél.
A mineralizáció egy másik fázisában - a nitrifikációban - az ammónia és a sók nitritté oxidálódnak (B.nitrosomonas segítségével), a szagok pedig nitrátokká oxidálódnak (B.nitrobakter segítségével). Az ammóniumsók nitrittel történő helyreállításához meg kell győződni arról, hogy a víz a közelmúltban szerves anyagokkal szennyeződött. A nitrátok a szerves vegyületek mineralizációjának végtermékei, jelenlétük a víz hosszú távú szennyezettségének mutatója.
A nitrogénvegyületek segítségével megállapíthatjuk a vízszennyezettség jelenlétét, és lesz információ a szennyeződés koráról. Így, ha az ammónia jelenléte a vízben az ismételt elemzések során már nem növekszik, akkor arra a következtetésre lehet jutni, hogy a víz szennyeződött, és már nem szennyeződik. Az ammóniával egy időben nitritek jelennek meg a vízben, ami arra utal, hogy az utóbbi időben szisztematikusan szennyezett víz van. Ha pedig ammónia, nitritek és nitrátok vannak a vízben, akkor ez egy rendkívül kedvezőtlen víztározóra utal, vagyis a régóta fennálló és folyamatosan szennyezett víztározóra.
Ha a víz minden nap nitrátot, ammóniát és nitrátot mutat, az azt jelzi, hogy a szerves anyagok mineralizációs folyamatai befejeződtek, így a szennyeződések megszűntek.
Meg kell azonban jegyezni, hogy nem a víz szerves hulladékáramokkal való szennyeződése az egyetlen oka annak, hogy nitrogéntartalmú patakok jelennek meg a vízben. A mélyen fekvő tiszta vizekben minden nap savanyúság léphet fel, ami által mosások jönnek létre a nitritek és az ammónia ásványi hulladékainak megújulására. A sós ammónia és a nitritek koncentrációjának ez a fajta növekedése a mély rétegközi vizekben nem utal elzáródásra. A vízelzáródás egyéb jelei a nap folyamán jelentkeznek.
A vízzel átitatott vízben lévő ammóniumsók, nitritek és nitrátok bomlástermékek lehetnek, és szerves anyagok vizes lerakódásának termékei. A nitrogéntartalmú anyagok az ipari szennyvizeken keresztül a vízellátásból, valamint az egyértelműen nitrogéntartalmú anyagokkal trágyázott területek szennyvizeiből is elveszhetnek.
Így a nitrogéntartalmú vegyületek vízben való jelenlétének helyes higiéniai értékeléséhez meg kell állapítani a vízben való megjelenésük okát. A vízben található szerves anyagok szennyezettségéről kedvezőbb az a tény, hogy a vízben található ásványi nitrogéntartalmú vegyületekkel párhuzamosan a szennyeződés egyéb mutatói is megjelennek: kémiai (magas oxidáció) és mikrobiológiai (alacsony mennyiség, nagy mennyiségben). U csapvíz, amely szennyezetlen lehet, az ammóniumsók és a nitritek, mint a vízben előforduló járványügyi problémák közvetett indikátorai, elvesztik jelentőségét. Prote, a klórral nem szennyezett csapvízben ammóniumsók helyett a koncentráció ne haladja meg a 0,5 mg/l-t, mert kevesebb hatóanyag – klóraminok – hozzáadásával a fertőzéshez szükséges klór-vitrát 2-4-szeresére nő.
A helyi vízellátásban a megállapított higiéniai előírások miatt az ammóniumsó nitrogén 0,1 mg/l-ig, a nitrit nitrogén - 0,002 mg/l-ig megengedett. Ásványi vagy algatevékenység következtében jelentősek az elzáródás indikátorai, és víz helyett használhatók.
Külön érdekesség a nitrátok elvesztése, amelyek magas bűzkoncentráció esetén methemoglobinémiát okoznak. A belekben lévő nitrát jelenlegi elmélete szerint az emberek továbbra is nitrálnak az új baktériumok beáramlása alatt. A nitritek nedvesítését addig végezzük, amíg a methemoglobin stabilizálódik. A betegség tehát a savanyú éhezés azonos stádiumán alapul, melynek tünetei először a gyermekeknél jelentkeznek, különösen a mellkasban, ami egyéni készítésnél (a száraztejkeverékek vízzel való hígítása a költéshez) fontos. vagy elfogyasztva a víz ára pityaért. Az idősebb gyermekek és felnőttek kevésbé fogékonyak a betegségekre, mivel náluk erősebb a kompenzációs mechanizmusok kifejeződése. A nitrátok koncentrációja 45 mg/l (NO 3 -dá alakítva), és biztonságosan elfogadott GDC-ként az ivóvízben. A nitrátok nagy koncentrációja elsősorban a talajvízben található, ami a víztartó kőzetek geokémiai jellemzőivel összefüggésben a tartós vízelzáródás (különösen a talajvíz) és az ásványianyag-változások öröksége. A vízzel átitatott vízben a nitrátok koncentrációja általában nem magas, és a megmaradt bűz a vízi szöszhöz kapcsolódik. A bűnös a vízzel és szennyvízzel való hatalmas szennyeződés előfordulása lehet, ami megakadályozza a nitrátokat.
A nitritek, mivel instabil vegyületek, nem halmozódnak fel toxikus koncentrációban a vízben, így methemoglobin tartalmú hidroxidként nincs jelentőségük.
A fogszuvasodás egyik legfontosabb oka az ivóvíz fluorhiánya, és ennek következtében a szervezet fluorhiánya. Ügyeljen a fluor ivóvízben való közvetlen jelenlétére és a fogszuvasodás veszélyére. A fluor a kalciummal és a foszforral együtt biztosítja a kefék és a fogak keménységét és puhaságát.
A fluor áztatás után hematogén hatású scilicointestinalis traktus. A fluor egyrészt serkenti a fog mineralizációs folyamatát, másrészt fluorapatitist eredményezve megváltoztatja a fog keményszöveteinek szerkezetét, ezáltal növeli azok ellenállását a kémiai és biológiai szuvasodást okozó tényezőkkel szemben, amelyek a száj üres.
A felszíni vizekben a fluorion koncentrációja 0,5 mg/l-ig fontos, ezeknek a vizeknek a vize a legtöbb közepes és nagy helyen vikorista. Az ivóvíz optimális fluorkoncentrációja 0,7-1,2 mg/l. A fluor alacsony koncentrációja növeli a fogszuvasodás súlyosságát. A fluortöbblet (1,5 mg/l felett) fluorózishoz vezet, ami hatással van a reproduktív egészségre, különösen a gyapot esetében. A légúti megbetegedések gyakorisága és a fluor magas koncentrációja megbízható.
Amikor a fluortartalom 0,5 mg/l alatt van, a csapvíz fluorozása javasolt, ami 65-70%-kal csökkenti a fogszuvasodás előfordulását. Érdemes megjegyezni, hogy a vízből a fluor 20%-kal gyorsabb, mint a termékekből, ami biztosítja a gondos beszerelést a víz fluorozása előtt. A víz jelenlegi fluorozása mellett fluoridtartalma a bőr éghajlati régiójában megengedett maximális érték 70-80%-a között van. Ha a fluor a tengerszint felett van, a vízben fluormentesítés léphet fel.
Az ivóvízben a természetes víztározásra jellemző kémiai elemek és sók keveréke tartalmazhat jelenlévő vegyszereket és ipari és mezőgazdasági vizekben elveszett anyagokat, valamint folyadékfelesleget, valamint a mintavételt követő egy órán belül a vízbe adagolt patakokat. víztisztító telepeken. Számukra létrehozták a GDK-t a SanPiN-ekben bemutatott módon. Az egyik ilyen elem a felesleges aktív klór, amelyet a szennyezetlen vízhez adnak. A nem szennyeződés hatásának elérése érdekében klórtartalmú készítményeket adnak hozzá kis mennyiségben, hogy 30 percnyi vízzel és klórral való érintkezés után (ez elegendő a mikroorganizmusok vegetatív formáinak csökkentésére) bizonyos feleslegben legyen a vízben ( felesleg vízben). 0,3 és 0,5 mg/l között van. Nagy mennyiségek kellemetlen szagot kölcsönöznek a víznek, különösen a vízben lévő fenolok és a halogénezett szénhidrátok jelenléte miatt, amelyek rákkeltőek lehetnek.
| Statisztikák a témában: | |
|
Az erkélyek és loggiák ablakaihoz redőnyöket választunk
Az erkélyen lévő redőnyök optimális megoldást jelentenek a csendes és mindennapi élettérhez... Nem turbó korall szín a belső térben Kék és korall integrálása a belső térben
És egy ilyen szín, amivel nagyszerű... Rhododendron ültetése és gondozása Kanadai rododendron ültetése és gondozása
A külföldi szakirodalomban a rododendronokat egy növénycsoporthoz hozzák termeszteni. | |