Изберете читатели
Популярна статистика
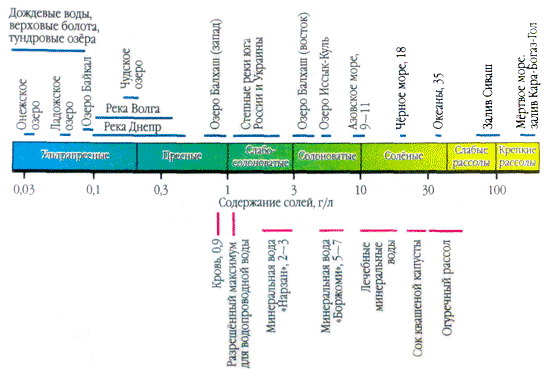
Ако нанесете капка естествена вода върху повърхността и я разтриете, докато се изпари, тогава на мястото на капката ще се види бяло отделяне - и солите във водата кристализират. Наличието на соли в природните води се увеличава хиляди пъти. Например, един литър дъждовна вода съдържа една или повече десетки милиграма соли. И в литър вода от входа Кара-Богаз-Гол (Каспийско море) - 300 g, може би една трета от масата.
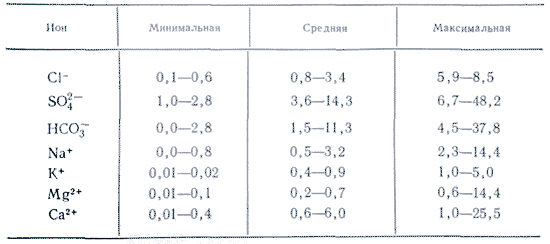
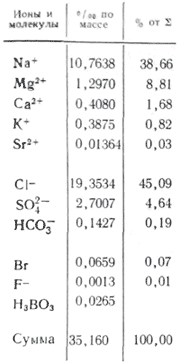
Във водните приложения повече соли са важни като йони. В естествените води три аниона са важни ( хидрокарбонат HCO 3 -, хлорид Cl -і сулфат SO 4 2-) и няколко катиони ( калций Ca 2+, магнезий Mg 2+, натрий Na+і калий К+) - те се наричат главни йони. Хлоридните йони придават солен вкус на водата, сулфатните йони, калциевите и магнезиевите йони са горчиви, хидрокарбонатните йони не са пикантни. Миризмите в сладките води са над 90-95%, а в силно минерализираните води - над 99% от всички реки. Долната граница на концентрация за основните йони е 1 mg/l, така че в някои случаи, например за морски и някои подпочвени води, Br - , B 3+ , Sr 3+ и др. също могат да се добавят към основните компоненти. Добавянето на K + йони към броя на главата и гърба. В подземните и повърхностните води тези йони, като правило, заемат различна позиция. Само K+ йони в атмосферните отлагания могат да играят основна роля.
Протейонната форма на основните компоненти на силата винаги е от полза за нискоминерализираните води. Когато концентрацията между йони се увеличи, тогава ще има взаимодействия, пряка връзка. процес, обратна дисоциация. В този случай се създават свързани йонни двойки, например MgHCO 3 + CaHCO 3 + .
С навлизането на климатични и други умове, химическото съхранение на природните води се променя и създава характерни модели, някои специфични за различни видове природни води (атмосферни отлагания, реки, езера, подземни води).
Атмосферни отлаганияВсички природни води са най-малко минерализирани, но зад химическото съхранение на техните вещества, вонята е не по-малко разнообразна от другите природни води. Складът на Jerelom е аерозоли от атмосферата. В склада има разнообразие от различни видове. Когато има средно богата минерализация на атмосферни отлагания в европейската част на Русия в диапазона от 10-20 mg / l и екстремни стойности за цялата територия 3-4 и 50-60 mg / l йон Този склад се характеризира по строгост, а средните аниони са най-важни SO 4 2- или HCO 3 - , а средата на катионите се поддържа на ниво разстояние, за да се спести Ca 2+ или Na +. За да се избегне вятърът от морето, поради вятърното механично отстраняване на солите, концентрацията на хлор в отпадъците се повишава. В резултат на консервацията, водната концентрация на Cl - пада, а SO 4 2-, Ca 2+ и Mg 2+ обаче се движи нагоре. Причината за движението вместо SO 4 2- и Ca 2+ е обогатяването на атмосферата с аерозоли на континенталното движение. Тъй като светът се придвижва по-дълбоко в континента, някои от морските аерозоли се отмиват. Концентрацията на SO 4 2- показва най-големи промени. Ако добавянето на Ca 2+ и Na + е свързано заедно с минерален трион от почви и пори, на чиято повърхност винаги присъства сол, тогава добавянето на SO 4 2 се поставя от едната страна, окисляването на SO 2 и H 2 S, в противен случай - издигането на киселинни соли от солени повърхности.
Невъзможно е да се получи приблизителна оценка на големия брой солни частици, които се издигат от почви, солени езера, върху повърхността на лед, торове и широколистни вещества, които се отделят като химически и металургични вещества. те се отделят в атмосферата като в резултат на други човешки дейности и след това се отмиват от отпадъци.
Води по-голямата част от рекатапринадлежат към класа на хидрокарбонатите. Зад съхранението на катиони тази вода може да съдържа и калций; Дори рядко се срещат хидрокарбонатни води с високи концентрации на магнезий и натрий. Природните води от хидрокарбонатния клас имат най-голямо количество вода с ниска минерализация (общо съдържание на соли до 200 mg/l).
Реките с вода, достигаща сулфатен клас, са почти безброй. Вонята е по-широка, особено в степните смутита и често в празните. При съхранението на катиони в естествените води от сулфатния клас, както и във водите от хидрокарбонатния клас, преобладава калцият. Въпреки това, редица реки в класа на сулфатите са с наднормено тегло от натрий. По минерализация водите от сулфатния клас значително превишават водата от хидрокарбонатния клас. Речните сулфатни води с ниска (съдържание на твърдо вещество до 200 mg/l) и средна (съдържание на твърдо вещество от 200 до 500 mg/l) минерализация рядко нарастват равномерно. Най-характерното за тази река е ниската (солеността е от 500 до 1000 mg/l), която е с висока (солеността над 1000 mg/l) минерализация на водата.
Установено е, че реки, чиито води достигат ниво на хлорид, са толкова редки, колкото и реки, чиито води съдържат сулфати. Преди тази територия се намират най-важните степни райони, но напразно. Най-важните катиони на природните води са от хлоридния клас, главно натриев. Водите от хлоридния клас са с висока минерализация - над 1000 mg/l, над 500 до 1000 mg/l.
Характеристиките на йонното съхранение на речната вода се извършват до летния период. До пеещия свят, той характеризира склада и по време на часа на ледопада. Това означава, че през пролетния сезон се избягва по-малко минерализация на водата.
Съществува последователен модел в разпределението на съхранението на йони в речната вода в Русия. Има обща тенденция към повишена минерализация на водата в по-голямата територия на европейската част на Русия от ден на ден и от началото на спускането. Зоналността на йонното съхранение на речните води се обяснява с действието на съзнателните за климата умове на настоящето и с климата на миналото. Нивото на влажност на почвите и скалите, наличието на лесно летливи соли в тях и солеността на почвите е естествен резултат от богатия приток на различни климатични умове. Разрушете зоналността на химическия склад на водата на реката на Русия и значението на склада на видовете и умовете на тяхното замърсяване.

Минерализация и химическо съхранение на езерната водаПромяната от река към река се променя в много широки граници. Реки с минерализация на водата над 100-200 mg/l, по някаква причина е имало смрад, са рядко явление, докато минерализацията на езерната вода е дори ниска, няколко десетки mg/l (напълно малки повишения от дъската) до много висока 3 -3,5% (солени езера с розова саламура до ръба, напоена със соли). Съдържанието на минерализация се влияе от съхранението на йони в езерната вода. Никой не е наясно със законите, силата и химичното съхранение на речната вода. При повишена минерализация на езерната вода се наблюдава бързо нарастване на йоните в нейното съхранение в следната последователност: HCO 3 - →SO 4 2- →Cl -; Ca 2+ → Mg 2+ → Na +. При минерализация 500-1000 mg/l в езерната вода преобладават хидрокарбонатните йони, над 0,1% - най-често сулфатните, а след достигане на 0,3-0,5%, в зависимост от литоложките характеристики на водата.сладка вода - сулфатна или хлоридна вода . При съхранението на катиони в езерните води ролята на калция е важна; спестяват се по-малко от 0,1-0,2%. Тъй като минерализацията се увеличава допълнително, натрият започва да играе тази роля. Те задържат магнезия, както всички други води, в междинна позиция по време на всички минерализации. Причината за това разделение на йонния състав се крие в различните видове соли. Най-важната част от пресни езера, като реки, зад съхранението на хидрокарбонатно-калциеви води.
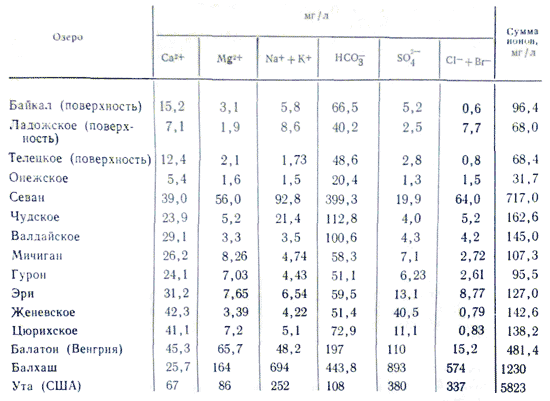
наличност морска вода характеризиращ се с голямо количество соли. В континенталните води най-често се наблюдават следните съотношения на концентрация: HCO 3 - > SO 4 2- > Cl - и Ca 2+ > Mg 2+ > Na + или Ca 2+ > Na + > Mg 2+, след това за солени и морски води, започвайки от халал минерализация от 1 g/kg, съотношението се променя: Cl - > SO 4 2- > HCO 3 - и Na + > Mg 2+ > Ca 2+. Промяната в съотношението между водите от речни към морски води се обяснява с неотдавнашния напредък в значението на нискокачествените соли в света на повишената минерализация на водата. Общо те и половината от основните компоненти представляват 99,99% от всички компоненти в океанската вода и минералните потоци.
Между елементите на основния солен склад на океанската вода, между кожата и тяхната сума, има практична стомана по отношение на концентрацията. Останалите yogo dov U. Ditmar, vykonav нов химичен анализ (хлориди, сулфати, калций, магнезий, натрий) 77 водни проби, доставени от всички океани от различни дълбочини на експедицията на "Чалънджър": във водата в открития океан, независимо от абсолютната концентрация на въглероден диоксид между основните компоненти на основния склад за сол винаги е постоянна (закон на Дитмар). PID с Viparovvannya. Такъв ранг, yakshcho vídomo, е времето на азотистите Kilkosti соли I концентрира, основните компоненти на 1 kg вода преди концентратите на същия Ingredi, лишеят за едно от поклоненията е в състояние да изчисли спасителния склад на океанско шофиране. В контекста на такава „референтна“ съставка има „хлорност“, която е няколко грама хлорни йони, еквивалентни на количеството халогени (включително флуориди, които не се утаяват от нитрати), присъстващи в 1 kg морска вода (възложено на Соренсен). Стабилността на запасите от океанска вода лесно се разрушава от притока на континентален отток, който се освежава, в естуарни зони и близо до вътрешни морета с труден водообмен с океана. В склада на основните компоненти концентрацията на калциеви и магнезиеви катиони, както и сумата от концентрацията на слаби киселинни аниони (HCO 3 -, CO 3 2-, H 2 BO 3 -) са значително по-ниски с 1% в стабилизирането на sp Добавен към връзката с дериватизирания карбонатен калций от водата в повърхностните топки и разграждането на водата върху глината.
Концентрацията на микроелементи в таблетката е малка, така че количеството на вонята надвишава 0,01% от теглото на всички разтворени соли. От задната аларма V.V. Гордева и А.П. Проследява се лизицин, в който най-високи концентрации включват литий (180 µg/l), рубидий (120 µg/l), барий (18 µg/l), най-ниски - злато (0,004 µg/l), редкоземни елементи (по-малко). от 0,001 µg k) радий (10 -7 µg/l).
Колкото повече морето е изолирано от океана, толкова повече съхранението на водата в него се различава от съхранението на вода в океана. От първостепенно значение са обменът на вода с океана, връзката между обема на континенталния отток и обема на морето, дълбочината на морето и характера на химическото съхранение на водата в реката, която се влива в него.
Подземни водиТе са обезпокоени от виолетовите цветове на химическия склад и йонния склад. Съхранение на вода се предлага във всички класове и групи типове. Първият склад на подземните води е първият, който се съхранява в съзнанието за тяхното образуване и замърсяване.
Природната вода има тенденция да поддържа стойността на рН по-малко стабилна, тъй като силно намалява киселинността на киселината или основата. Ако добавите капка концентрирана солна киселина към литър дестилирана вода, pH ще падне от 7 на 4. Ако добавите капка солна киселина към литър речна вода с pH = 7, стойността на pH може да се промени. Киселините и основите, които консумират естествена вода, се неутрализират от въглероден диоксид и хидрокарбонатни йони, разтворени в нея:
H + + HCO 3 - ↔ H 2 O + CO 2
OH - + CO 2 ↔ HCO 3 -
Хидрокарбонатните йони неутрализират киселини, които се губят във водата чрез атмосферни отлагания или се образуват в резултат на жизнеността на организмите. Устойчивостта на вода и киселинни киселини е пряко свързана с концентрацията на хидрокарбонатни йони. Най-чувствителните към тях реки са езерата на Карелия, Финландия, Скандинавия, във водите на които практически няма такива йони.
Органична река от естествени води е комплекс от наистина дезинтегрирани и добре оформени реки от органични резервоари. В зависимост от ситуацията органичните реки от естествени води могат да бъдат разделени на такива, които текат от дренажната зона и се установяват в близост до водното тяло. До първата група попада основната част от хумусни смеси, които се измиват с вода от почви, торф, горски хумус и други видове естествени разтвори, които включват излишни растения и органични вещества, които идват от индустрията и правителството. отпадъчни води. Сред хуминовите киселини за хидрохимията най-голям интерес представляват хуминовите и фулвинови киселини. Лошите киселини са характерни за хумуса (хуминовата киселина), миризмата не съществува в живите растителни и животински тъкани. Съотношението между тях в различните торфи и почви е различно. В черноземните почви по-важни са хуминовите киселини, а в подзолистите – фулвиновите киселини.
Концентрацията на органични вещества в естествените води, варираща в широки интервали, е най-висока в блатните води (които с висока концентрация на хумусно вещество понякога достигат 500 mg/l или повече) и реките с блатни таверни, а блатната вода е опетнен от кафяв цвятдо 300° и над платинено-кобалтовата скала на цветовата стойност (добавянето на естествена вода добавя хуминови киселини). Висока концентрация на inode за органична реч е концентрирана в подземни води, свързани с отлагания, съдържащи нафта.Дори по-големи концентрации могат да възникнат в естествени води, замърсени с промишлени и битови отпадъчни води. Незамърсените естествени води причиняват изтичане на малко органични вещества. Например за B.A. Скопинцев, в океанската вода концентрацията на органични вещества става по-малка от 2,0-5,4 mg/l (средно 3,0 mg/l, а в речната вода средно 20 mg/l).
В някои повърхностни води, особено в реки от блата, хумусните отлагания съставляват основната част от химичния състав на водата. След като реките, а след това езерата и моретата са добре аерирани, органичните части на водата са обект на промяна, а в почвите процесът на окисление е завършен в по-голямата си част чрез преход от проста минерална материя. Другата, устойчива част се губи и се натрупва във водоемите.
В студените климатични зони (тундра) има много малко органични излишъци и там водните резервоари може да не съдържат хуминови киселини. А в зоната на горите, особено иглолистните, където органичните остатъци са в изобилие и миризмите не се разтварят на повърхността, вместо хуминови киселини има няколко десетки милиграма на литър. Хуминовите киселини не само подкиселяват водата във водоема, но и свързват почти всички важни метали в комплекса.
Когато налеете студена вода от чешмата в бутилка и я поставите на топло място, по стените ще се появят мехурчета газ. Гази е разрушен през студена водаи се виждаха при нагряване (концентрацията на газовете се променя при нагряване). Това е кисел газ, азот и въглероден диоксид. Интензитетът на газа във водата има тенденция да намалява с повишаването на температурата, което е свързано с увеличаването на кинетичната енергия на газовите молекули, което намалява гравитационните сили на водните молекули. Всички природни води са източници на газ. Кислородът O 2 и въглеродният диоксид CO 2 са най-разпространени в повърхностните води, а кислородът H 2 S и метанът CH 4 са най-разпространени в подземните води. В значителни количества CO 2 може да присъства и във вода от дълбоки хоризонти. Освен това всички природни води постоянно съдържат азот N2.
Кисен (O 2)открити в естествената вода под формата на разбити молекули. Kisen, като силен окислител, играе специална роля при формирането на химичния склад на природните води. Кисен идва от водата в резултат на процесите на фотосинтеза, протичащи в природата и от атмосферата. Кисен се използва за окисляване на органични вещества, както и в процеса на дегенерация на организми. Концентрацията на разтворената киселинност в природните води варира между 0 и 14 mg/l, като при интензивна фотосинтеза са възможни и по-високи концентрации. Поради дългосрочната концентрация на киселина в повърхностните води поради ниски фактори, нейната концентрация значително се променя с продължителността на производството, сезона и съдбата. Остатъците от мъртвата киселинност едва ли ще останат поради промените в слънчевата радиация, а фотосинтезата зависи изцяло от нея; с напредването на деня киселинността се натрупва и тъмният час позволява тя да бъде консумирана. Киселото е необходимо за унищожаването на повечето организми, които обитават водите. Като силна окислителна киселина, тя играе важна санитарно-хигиенна роля, подпомагайки бързата минерализация на органичните излишъци.
Въглероден диоксид (CO2)да отговаря за водата, за да види разграждането на молекулите в CO2 газ. Въпреки това, част от него (около 1%) взаимодейства с вода, разтваряйки въглеродна киселина:
CO 2 + H 2 O ↔ H 2 CO 3
Уверете се, че не добавяте CO 2 и H 2 CO 3 и под въглероден диоксид в максимална степен (CO 2 + H 2 CO 3). В природните води въглеродният диоксид присъства преди процеса на окисление на органичните вещества, което се дължи на наличието на CO 2 както във водата, така и в почвите и повърхностите, върху които тече водата. Пред тях се чува дъхът на водните организми и различни възгледибиохимично разлагане и окисление на органични излишъци. В някои подземни води има важен източник на въглероден диоксид и вулканични газове, които могат да се видят над земята, появата на които е свързана с дегазирането на мантията и сложните процеси на метаморфоза на седиментни пори, които се случват там в глината под притока висока температура. Поради това често се избягват високи нива на въглероден диоксид в подпочвените води и глинестите резервоари. Освобождаването на въглероден диоксид от атмосферата от водата е по-важно за морските и океанските води и по-малко важно за сухоземните води. Замяната на въглероден диоксид с въглероден диоксид се получава по време на фотосинтезата. Дори при интензивна фотосинтеза, ако има намаление на подобен на газ CO 2, останалите йони могат да се видят от HCO 3 - йони:
HCO 3 - ↔ CO 3 2- + CO 2
Въглеродният диоксид също се използва за разграждане на карбонати:
CaCO 3 + CO 2 + H 2 O ↔ Ca(HCO 3) 2
Използва се и химическа витрификация на алумосиликати. Промяна на CO 2 във водата, особено в повърхностните води на сушата, също се наблюдава, когато се изпуска в атмосферата. Горящата атмосфера на CO 2 е от голямо значение за CO 2, който се намира в повърхностните води, като го регулира там. Между CO 2 атмосферата и CO 2 повърхностните води има непрекъснат обмен, насочващ установяването на равен баланс между тях, базиран на закона на Хенри-Далтон. Парциалното налягане на въглеродния диоксид в атмосферата е много малко (33 Pa), тогава, независимо от голямата му сила (при налягане от 1013 hPa и температура от 12 °C до 2166 mg/l), балансът между водата и атмосферата се достига с много малко mu с CO 2 във водата. При парциално налягане на CO 2 в атмосферата от 33 Pa концентрацията му във вода ще бъде 2166.0.00033 = 0.715 mg/l (при 12 °C). Благодарение на повърхностните води на сушата, в които протичат различни процеси на разграждане на органични вещества и почви, се извършва по-голямо количество CO 2 и следователно се отделя в атмосферата. Освен ако фотосинтезата не е много силна, ако има CO 2, CO 2 може да бъде отстранен от атмосферата. Вместо въглероден диоксид в природните води той е изключително променлив - до няколко десети пъти до 3000-4000 mg/l. Най-ниската концентрация на CO 2 се наблюдава в повърхностните води, особено минерализираните (мора, солени езера), най-високата в подземните и замърсените отпадъчни води. В реките и езерата концентрацията на CO 2 рядко надвишава 20-30 mg/l.
Rozchinny молекулярен азот (N 2)- Най-стабилният газ в естествени води. Химически най-стабилният и биологично важен азот, въведен в глинени топки в океана или подпочвените води, се променя бързо само под въздействието на физически сили (температура и налягане). В случай на повърхностни води, азотът играе важна роля във водоснабдяването. В природата има широко разпространено увеличение на биогенния азот, което е резултат от денитрификация.
Газ метан (CH4)достигат до най-големите газове и подпочвени води. В газовата фаза на подземните води често преобладават азот, въглероден диоксид или метан. Основният източник на образуване на метан са диспергирани органични съединения в скалите. Метанът, който е важен във въглехидратите, често се среща в значителни концентрации в дълбоки подземни води на затворени структури, свързани с находища, съдържащи нафта. В ниски концентрации метанът се натрупва в естествени езера, където може да се види от мулето, когато са разположени високи дървета, както и в отлагания на океанското дъно в райони с висока биологична продуктивност.
Газ Сирководен (H 2 S)Това е един от продуктите на разлагането на протеинова материя, която се съхранява във вашия склад и поради това натрупването му често се съхранява в дънни топки с вода поради гниенето на различни органични излишъци. В долните части на дълбоките езера и морета, където има ежедневен водообмен, често се развива дълбоководна зона. При парциалното налягане на водата в атмосферата под нулата е невъзможно наличието на вода в повърхностните води. Освен това виното се окислява от киселинността, която се разтваря от водата. В реките дълбоките води са ограничени предимно в дънните басейни, особено през зимния период, когато аерацията на водния обект е затруднена. Наличието на водна вода в естествени, незамърсени повърхностни води е рядко явление. Много по-често водата присъства в изолирани от повърхността подземни води и в силно замърсени повърхностни води, в които вината служат като индикатор за силно замърсяване и анаеробно оттичане.
Освен тези във водата, редица елементи: азот, фосфор, силиций, алуминий, слюнка, флуор присъстват в концентрации от 0,1 до 10 mg/l. Вонята се нарича мезоелементи (от гръцки "Mesos" - "среден", "междинен").
Азотът под формата на нитрати NO 3 - се губи във вода и трапезна вода и под формата на аминокиселини, соли (NH 2) 2 CO и амониеви соли NH 4 + - при изхвърляне на органични излишъци.
Фосфорът присъства във водата под формата на хидрофосфати HPO 3 2- и дихидрогенфосфати H 2 PO 3 - създадени в резултат на разлагането на органични излишъци.
Силицият е съществен компонент за химическото съхранение на природните води. Това се дължи на наличието на други компоненти навсякъде в присъствието на силиций в планинските скали, а малкото разнообразие на останалите компоненти обяснява минималното съдържание на силиций в питейната вода. Концентрацията на силиций в природните води е няколко милиграма на 1 литър. В подпочвените води тя се повишава и често спада до десетки милиграма на 1 литър, а в горещите термални води - до стотици. В допълнение към температурата, чувствителността на силиция се влияе силно от промените на pH. В повърхностните води има малко количество силиций, който се редуцира до силициев диоксид (125 mg/l при 26 °C, 170 mg/l при 38 °C), което показва наличието на процеси във водата, които променят концентрацията му. Преди тях е необходимо да се въведат богати на силиций водни организми, много от които, например диатомовите водорасли, ще образуват своя силициев скелет. В допълнение, силициевата киселина, като слаба киселина, се различава от въглеродната киселина:
Na 4 SiO 4 + 4CO 2 + 4H 2 O = H 4 SiO 4 + 4NaHCO 3
Намалява нестабилността на силиция поради склонността на силициевата киселина да се превръща в гел. В много слабо минерализираните води силицият става източник, а понякога и важна част от химичния състав на водата, без значение изобщо. Наличието на силиций във водата е сериозен дефект в технологията, тъй като когато врящата вода е напълно суха, силицият създава много твърд силикатен котлен камък в котлите.
Алуминият присъства в близост до водата поради наличието на киселини върху глината (каолин):
Al 2 (OH) 4 + 6H + = 2SiO 2 + 5H 2 O + 2Al 3+
Основното находище е глина. Органичните остатъци (наричани по-нататък "С"), когато са в контакт с тях, намаляват съдържанието си до двувалентен, който се абсорбира напълно под формата на хидрокарбонат или соли на хуминови киселини:
2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 = 4Fe(HCO 3) 2
Когато вода с разтворени Fe 2+ йони влезе в контакт с вода, тя бързо се окислява, създавайки кафява утайка от Fe(OH) 3 хидроксид. Тази година се превръща в блатна руда - кафяв бурен (лимонит) FeO(OH). Карелската блатна руда е добивана през 18-19 век за извличане на облицовката.
Синята слюнка на повърхността на водата е Fe(OH) 3, която се разтваря, когато подпочвените води, съдържащи Fe 2+ йони, влязат в контакт с повърхността. Те често се губят в стопения полиетилен, но е много лесно да ги нарежете: стопеният хидроксид ще заздрави разкъсаните ръбове. След като течността излезе на повърхността на водата, изстискайте стопения хидроксид в съд с масло, за да не прелее.
Тази група включва елементи, които се намират в природните води в много малки концентрации, затова се наричат микроелементи. Тяхната концентрация варира в микрограмове на 1 литър (mcg/l), като често има и по-високи стойности. Микроелементите са най-голямата група от елементи в химичния състав на природните води, те включват всички елементи от периодичната система, които не са включени в предишните групи компоненти. Те могат да бъдат психически разделени на пет подгрупи: 1) типични катиони (Li +, Rb +, Cs +, Be 2+, Sr 2+, Ba 2+ и т.н.); 2) йони на важни метали (Cu 2+, Ag +, Au +, Pb 2+, Fe 2+, Ni 2+, Co 2+ и т.н.); 3) амфотерни комплекси (Cr, Mo, V, Mn); 4) типични аниони (Br -, I -, F -); 5) радиоактивни елементи. Микроелементите са необходими за нормалния живот на растенията, животните и хората. Но при повишени концентрации много микроелементи са вредни и вредни за живите организми. Затова вонята често се стопява в кални звуци и концентрацията им се контролира. Успешното култивиране на микроелементи е трудно поради малкото им присъствие в естествените води и поради голямата несигурност на формата на тяхното присъствие във водите. Остава трудно да се обяснят моделите на тяхната миграция и режим и създава трудности при химичния анализ. Например много важни металиТе мигрират във високи концентрации към виталното, а не към разстроеното състояние. Разпаднатите органични комплекси създават повечето метали, преди всичко тривалентни метали с хуминови и фулвинови киселини. Концентрацията на комплексирани метали се изчислява преди концентрацията на органични киселини. Външният вид на скалите е богат на метални хидроксиди. Възможно е да се получи адсорбция на органични вещества върху повърхността на колоидите, което им дава по-голяма стабилност при разпадане.
Химически складтогава естествената вода означава предишната история. пътища, образувани от водата в процеса на нейната циркулация. Редица различни речи в такава вода се отлагат, от една страна, от склада на тези речи, с които течеше, от друга - от умовете, с които те взаимодействаха помежду си. Следните фактори могат да добавят вода към химически резервоар: планински скали, почви, живи организми, човешка дейност, климат, релеф, воден режим, растителност, хидрогеоложки и хидродинамични условия и др. Нека разгледаме по-отблизо факторите, които се вливат в резервоара за вода.
Гниенето на почвата и атмосферните утайки, които се филтрират през почвата, водят до разграждане на скали и минерали. Това е едно от най-важните влияния върху почвата, което се влива в формовъчния склад на естествените води, което води до повишена концентрация на въглероден диоксид в почвата, което се наблюдава при изсушаване на живи организми и коренови системи в почвите и биохимично разграждане на органични излишъци. В резултат на това концентрацията на CO 2 в почвения въздух се увеличава от 0,033%, в атмосферния въздух, до 1% или повече в почвения въздух (при важни глинести почви концентрацията на CO 2 в почвения въздух Вятърът достига 5 -10%, като по този начин придава силно агресивно действие според възрастта на породата). Друг фактор, който засилва агресивното действие на филтрираната през почвата вода, е органичното вещество - почвен хумус, който се установява в почвата при преобразуването на излишната растителност. При съхранението на хумус в контейнера с активни реагенти трябва първо да посочим хуминови и фулвинови киселини и прости вещества, като органични киселини (лимонена, кисела, окстоинова, ябълчена и др.). Добивът на почви, богати на органични киселини и CO 2, често се ускорява от химическата витрификация на алумосиликатите, които се намират в почвите. По същия начин водата, която се филтрира през почвата, ускорява химическата вибрация на алумосиликатите и карбонатните скали, които са в основата на почвата. Вапняк лесно разтваря нискокачествен (до 1,6 g/l) калциев хидрокарбонат:
CaCO 3 + H 2 O + CO 2 ↔ Ca(HCO 3) 2
В цялата европейска част на Русия (Крим на Карелия и Мурманска област) находищата, както и доломит MgCO 3 .CaCO 3, лежат близо до повърхността. Затова е важно водата тук да съдържа калциев и магнезиев хидрокарбонат. В реки като Волга, Дон, Северна Двина и техните основни притоци калциевият и магнезиевият хидрокарбонат се превръщат в 3/4 до 9/10 от всички разтворени соли.
Солите се консумират от водни басейни и в резултат на човешка дейност. Затова пътищата се поръсват с натриев и калциев хлорид, за да се стопи ледът. През пролетта хлоридите се събират заедно от стопената вода в реката. Количеството хлориди в реките на европейската част на Русия е донесено от хората. В близост до реките, на които се намират големи места, тази част е по-богата.
Релефът на находището индиректно влива резервоар от вода, поглъщащ изнасянето на соли от почвата. Дълбочината на ерозивния врез на реката улеснява достигането до реката с по-минерализирани подземни води от долните хоризонти. Който може да побере други видове депресии (речни долини, дерета, дерета), които подобряват дренажа на водосбора.
Климатът създава знойен фон, който позволява протичането на по-голям брой процеси при образуването на химически резервоар от природни води. Климатът зависи преди всичко от баланса на топлина и вода, който определя отлаганията на почвата и обема на водния поток и следователно разреждането или концентрацията на природните смущения и възможността за унищожаване на реките или попадането им под обсада.
Много е важно химическият склад на водата да се развие в голям поток и да се промени живота на водното тяло и връзката му с течение на времето. През периода на топене на снега водата в реките, езерата и резервоарите е с по-ниска минерализация, през периода, когато най-много живот идва от почвените и подпочвените води. Ето защо мебелите се използват при регулиране на повърхността на водата и отстраняване на водата от тях. По правило дренажните басейни се допълват през пролетния сезон, ако приливната вода има по-малка минерализация.
Химическото съхранение на водата може да бъде различно и фрагменти могат да лежат на мястото на частици от неорганични и органични вещества. Течейки през различни части на земята, водата разгражда съдържащите се в тях соли (калций, магнезий и др.).
Въртяйки се на повърхността на земята, водата се натрупва с газове, разтваряйки ги. Природните води са отделени от химическия склад в един вид, така че те са образувани от газове, основни йони, биогенни и органични вещества и микроелементи.
Голям приток на вода и съхранение на химикали се прилага към почвата и леглото. Водата премахва минерални и органични вещества от почвата, което се пази особено внимателно през първите етапи на експлоатация.
Газовият режим в естествените и изкуствените резервоари се формира от комбинацията от газове, които се изпускат от атмосферата и в резултат на химични процеси. Голям брой разтворени газове остават поради температурата, налягането и наличието на соли във водата.
Тези газове, и на първо място киселинността и въглеродният диоксид, са просто необходими за живота на водните организми. Колкото повече са близо до водата, толкова по-добре е за хората във водния басейн. Високото съдържание на вода, метан и азот обаче намалява жизнеността на живите същества.
Един от най-важните газове, които постоянно присъстват в повърхностните води, е киселият газ. В химико-биологичните води има значително количество вода.
Главните джерели се заливат с кисела вода
- атмосферата - под надигащия се вятър, се слива с повърхностните топки вода;
- Фотосинтеза на микроскопични водорасли.
При високи температури киселинността на водата се променя, а при ниски се повишава.
Киселинността на водата в природните води е по-малка от 100%, тъй като обемът на този газ преминава в окисляването на органични вещества. При масово развитие на водорасли (през зимата) в големи водоеми, киселинността може да достигне 150-200%.
Въглеродният диоксид (CO 2) присъства в големи количества във всички природни води. В този случай повечето въглероден диоксид присъства в разтворено състояние и малко количество въглероден диоксид (до 1%) може да взаимодейства с вода и да създаде въглеродна киселина.
Увеличаването на концентрацията на въглена киселина в сместа за оптимално ниво се основава на концентрацията на органични вещества. Особено важно е да се регулира производството на киселинност и въглена киселина.
За да се определи химичният състав на водата и естеството на нейното изменение, трябва да се извършат лабораторни изследвания. Основна информация за киселинността на водата може да се получи с помощта на специален уред, който се използва за изследване. е ясен блок с два рова и цветна скала.
В присъствието на тези и други химикали, водата, която се тества, развива отчетлив цвят, който съответства на цветовата скала на скалата. Скалата на цвета на кожата се определя от нивото на киселинност на водата.
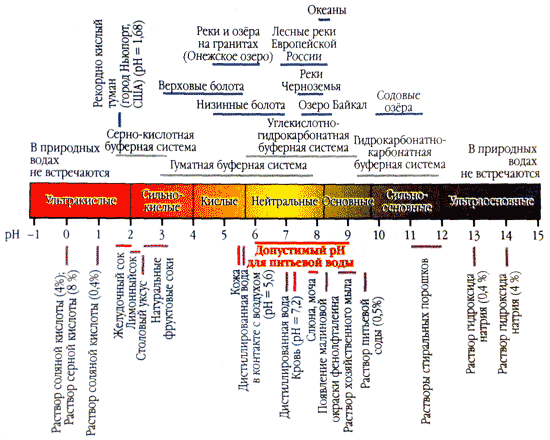
Киселинността на водата (pH) характеризира активната реакция на средата. Колкото по-близо до нула е стойността на рН, толкова по-висока е концентрацията на водни йони в разтвора, толкова по-кисела е средата.
Оптималният показател за киселинност на водата за човека е в тесния диапазон от 7,2-7,4, при максимум 7,6. При такова равно рН водата не тече върху човешката кожа и предотвратява размножаването на микроорганизми.
Ако стойността на pH е по-висока от 7,8, такава вода дразни кожата (особено чувствителната) и микроорганизмите могат лесно да се размножават във вода. В допълнение, висок ревен pH насърчава корозивната активност на водата, което значително влияе върху ефективността на притежанието и комуникацията.
Най-високите нива на pH на водата (8-8,8) се наблюдават през другата половина на вегетационния период, когато биомасата на водораслите достига най-голямо развитие и процесите на фотосинтеза протичат с максимална интензивност.
В резултат на химични реакции като водата. Нивото на рН постепенно се променя, както с водата, така и с поетата вода.
Твърдостта на водата оказва силно влияние върху нивото на pH. Да, да мека вода pH на ревена е под 7,0, а на горчивия може да достигне 9,0.
Твърдостта на водата се определя вместо Ca CO2 (). Когато настъпят температурни промени, утайката пада върху стените на басейна, филтрите, топлообменниците и друго оборудване.
Според стандартите твърдостта на водата не трябва да надвишава 30°dH, където 1°dH = 10 mg CaO/l. Твърдостта на водата може да се промени, докато престоява дълго време. През зимата тя намалява допълнително през дъждовния сезон.
Окисляването на водата се определя от използването на различни органични и минерални вещества.
Степента на окисляване показва колко окисление се губи при разрушаването на органичните вещества (mg/l). По време на текущия вегетационен период окислението на водата се променя от 10 до 30 mg на 1 литър или повече.
Химически склад за вода. В природата е обичайно водата винаги да съдържа повече или по-малко от своите минерални соли. стъпка минерален складВодата се определя от естеството на почвата или почвите, лежащи до водоносните хоризонти или повърхностните водни резервоари.
Количеството минерални соли, подобно на водата, се изразява в mg/l.
Органични речи. От тях най-важни са думите на пътуването на съществото, фрагментите от вонята могат да съдържат различни патогенни микроби. Косвен хигиенен индикатор за наличието или присъствието на тези вещества във водата е окисляването на водата.
Окисляване на вода. Количеството киселинност (mg), което се изразходва за външно окисление на органични вещества, което се съдържа в 1 литър вода (посочено като mg/l). Колкото по-малка е киселинността на водата, толкова по-малка е киселинността на повърхността на окисление в 1 литър вода с органични съединения. Например, окисляването на чистите подпочвени води е не повече от 2-4 mg/l, речните води не повече от 7 mg/l.
Един от показателите за възможното наличие на органични киселини във водата е количеството на разтворената в нея киселинност (mg). В чистите води се отделят 3-6 mg/l кисела вода, а в замърсените - много по-малко, до пълно отсъствие.
Наличието на амоняк, азотни соли и азотни киселини може да се наблюдава в присъствието на амоняк, азотни соли и азотни киселини. Амонякът е продукт кочан етапигниене на органични отпадъци от готвене, а солите на азотната и азотната киселина са крайните продукти на минерализацията на органичните отпадъци. Видно е, че водата е запушена от дълго време.
Наличието на соли на солна и кисела киселина във водата е индикация за възможно замърсяване на водата с екскременти на животни и хора (фекално замърсяване). Считайте, че 1 литър чиста натурална вода съдържа малко повече от 20-30 mg хлориди.
Твърдостта на водата. Показан е вместо калциеви и магнезиеви соли. Разделете водата на малки части, едно по едно. Можете да видите естествената твърдост на водата - твърдостта на сивата вода, специфичната твърдост, която се променя при варене или престояване, а не при преливане, която не намалява след кипене на водата.
Зеленчуците и месото се варят лошо в твърда вода, тъй като съдържащите се в тях протеини се комбинират с калций и магнезий в неорганични вещества, които не се абсорбират в човешките черва.
Такава вода не е подходяща за хигиенни процедури: съдържа прекомерно количество соли, които преливат, а нежеланите остатъци се утаяват върху косата и образуват мита.
Твърдостта на питейната вода може да надвишава 7 mg/l. Тази характеристика може да бъде изразена в градуси (1 mg/eq твърдост на водата е равен на 2,8 °). Твърдата вода е вода, която е над 20°, меката вода е под 10°.
Изсипват се солети. Водата, която се излива не е евтина, но в извънредни количества придава горчив метален вкус и жълтеникав или жълтеникаво-кафяв аромат, намалявайки бистротата. В питейната вода се допуска съдържание до 0,5 mg/l (в студени водоеми) и 1,0 mg/l (в подземни водоеми).
Флуор. Каквото и да има в питейната вода, тя значително се стича върху зъбите. При повишаване на концентрацията възниква флуороза (поява на тъмни петна по емайла на зъбите), което води до тяхното по-нататъшно разпадане, а при недостатъчен кариес зачестява кариесът. Водата съдържа не повече от 1,5 mg/l флуор, оптималната киселинност е 0,7-1,0 mg/l. Ако флуоридът не се отстрани, водата трябва да се флуорира индивидуално и да се добави натриев флуорид.
Естествените (сухоземни) водоеми имат естествени процеси на самопречистване, тъй като хората не могат да ги преодолеят:
*Без ултравиолетово лъчение;
*Утаяване и отделяне на важни частици;
*Окисляване на органични вещества поради съдържание на O2;
* Минерализация на органични излишъци поради бактериален растеж.
Страна 1
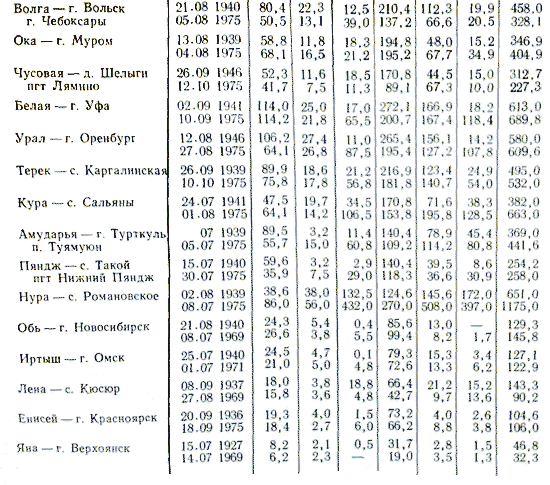
Съхранението на речните води се определя от количеството и силата на потоците, които се вливат в тях от земята и вятъра, както и отпадъчните води от промишлени и общински предприятия.
Класификацията на съхранението на речна вода е показана на фиг. 3.24 е опростен и не винаги се оказва ефективен.
Както е показано от обширни изследвания на съхранението на речна вода, регулирането на изпускането на вода от резервоара за съхранение не изисква толкова значителни промени, колкото може да се направи речната вода. използвайки съвременни методианализ.
Поради сезонните особености промените в съхранението на речната вода трябва да бъдат възстановени при проектирането на инсталацията. Класът на кожата на важни катиони е разделен на три групи: калций, магнезий и натрий. По свой собствен начин групата на кожата е разделена на четири типа вода, които се идентифицират с редица йони. Кремът съдържа важни катиони, речната вода съдържа йони K, NH4, Fe2, Mn2, Cu2, Zn2, Ni2, Fe3, Al3 и в по-ниски концентрации редица други йони.
За да се разбере характерът на изменението на мощността и потока на речните води по протежение на нафтоносните образувания, през 1957г. Сондажите на ТатНИПИнафта сами пробиха пет инжекционни сондажа.
Наблизо селищаА промишлените отпадъчни води могат да осигурят голям приток на промишлени отпадъчни води към склада за речна вода.
С насоки от табл. 3 фигури показват, че съхранението на речна вода варира в широки граници. Речните води, които текат през плодородни райони, са пълни с карбонати и високо съдържание на калций. Речните води, които текат през сухи райони (например в западната част на Съединените щати), съдържат повече сулфати, по-малко калций и следователно по-малко карбонати. Би било погрешно да се пренебрегне количеството органична течност, която се транспортира от водите, чиито фрагменти се превръщат в нафта.
Химическото съхранение на подпочвените води в крайбрежните водохващания е с други думи съхранение на речни води, което по свой начин се обозначава като хранилище на атмосферни валежи, а също и като хранилище на сняг, буря и подземен отток iv. В атмосферата се натрупва дъждовна вода и сняг голямо количествокиселинност, въглероден диоксид, азотен оксид, амониеви соли, а в замърсената среда на промишлени зони, както се има предвид веществото, към тях се добавят дървени стърготини, бактерии, сироп, продукти от изгаряне на въглища, нафта и други вещества.
В резултат на това само малко количество запушена канализационна вода тече в близост до реката, което води до изчерпване на съхранението на отпадъчните речни води, което елиминира възможността за по-нататъшна ликвидация.
Вонята се концентрира под формата на минерали, например гипс Ca8O4 - 2H2O, мирабилит Na28O4 - 10H2O, а също така влиза в хранилището на морска и речна вода.
Горните речни води (както и езерата и водите) се характеризират с изобилие от тяхното съхранение, което е резултат от живота на растенията и съществата, които са близо до водата, и основното събитие на пролетните наводнения в и дъските, които се отмиват от брегове значителен брой частици от почвата. В същото време, в близост до населени места, заустванията на отпадъчни води и отпадъци от промишлени предприятия често се вливат в зоната за съхранение на речни води.
Химическият склад в реката разпознава сезонните колебания. Най-голяма минерализация на речната вода има през периода, когато реката е наситена с подпочвени води, а най-малка се дължи на дъждовния сезон или живота на ледените покривки. Съхранението на речните води е в ръцете на физико-географските умове. В надземните зони минерализацията на водата е ниска. Минерализацията също се променя, когато реката тече в притока, водоприемникът, който се намира в други формовъчни басейни.
Съхранението на речната вода, както и на отпадъците, се съхранява до края на времето. През зимата има най-малко кал и най-голяма минерализация, но обратното е при наводнения, особено през пролетта. По време на съдбата метеорологичните канали, летните ветрове и други фактори се вливат в речния воден склад.
Химическият склад на природните води е много разрушим. Те имат повече семейство химически елементи, които се изчисляват в части от грамове или цели и дори десетки или стотици грама на литър вода. Това са елементите, намиращи се във водата, и появата на йони или молекули, които създават сложни структури, включително органични.
Етапът и характерът на минерализацията на водата в това и други находища се нарушава от водата. На мястото на разграждането на нелетни минерални и частично органични вещества във водата се характеризира количеството на сухия излишък (основното количество, съвкупността от хлориди, сулфати, карбонати и бикарбонати, ливадни и ливадно-земни метали). Водите, които съдържат голямо количество минерални соли, могат да придадат неприятен солен или горчиво-солен вкус, така че количеството суха излишна питейна вода е обект на санитарна практика поради влиянието му върху пикантната сила на водата в реката дори 1000 mg /л. Експерименталните изследвания показват, че оптималната (органолептични свойства) е питателна вода, която съдържа 200-400 mg соли на литър. Водата със сух излишък до 1000 mg/l се нарича прясна, а над 1000 mg/l – минерализирана.
Промените в първичното ниво на минерализация на водата, които не се дължат на естествени причини (пролетни наводнения), могат да се разглеждат като индикация за замърсяване на водата от реки от трети страни.
Хлоридите във водата се концентрират особено под формата на натриев хлорид и най-малкото под формата на други съединения (магнезиев хлорид и др.). В естествените води хлоридите се появяват в резултат на отстраняването им от почвените образувания. Зоните със солена почва са особено богати на хлориди. Хлоридите са важни като вещества, които променят вкуса на водата и влияят върху физиологичните функции на тялото. Започвайки от концентрация от 500 mg/l, хлоридите предизвикват потискане на секрецията на охлювите, което се отразява в промяна на киселинността и силата на сока от охлюви, който отравя. В резултат на това евакуацията на живот от кораба ще се ускори. При концентрация над 1000 mg/l, хлоридът води до промяна в диурезата, което може да бъде особено вредно за хора, които страдат от сърдечни заболявания и здравословни проблеми. При концентрации над 350 mg/l хлорид, добавете солена вода към сместа.
Хлоридите могат да бъдат загубени във водата от изпражнения, изрезки, кухненски отпадъци, за общинско водоснабдяване, вода, която не е податлива на замърсяване, хлоридите могат да бъдат важни като косвен индикатор за ежедневно замърсяване на водата. При които концентрацията на хлориди не се оценява, колко е промяната в часа и участъка на водата, тогава. увеличение срещу аварийни, естествени концентрации. Силното наличие на хлориди и амоняк в растения с висока степен на окисление и неприятни бактериологични показатели показва санитарните проблеми на тази вода.
Сулфатите в количества над 500 mg/l, добавете водно-солена глътка към водата, в концентрация 1000-1500 mg/l, и най-вероятно потискат секрецията на скутума, имат слабително действие върху червата и водят до негативно отношение към вкусовете на хората.поят своите якове. Сулфатите могат да бъдат индикатор за замърсяване на повърхностните води с животински екскременти, тъй като складовата част на протеиновите тела е сярата, която при разлагане и допълнително окисляване се превръща в сол на сярна киселина.
Твърдостта на водата показва концентрацията на двувалентни тревни метални катиони в нея, преди всичко калций и магнезий. Йоните Ca(2+) и Мg(2+) могат да бъдат свързани с различни аниони (HCO 3 , SO 4 , Cl , CO 3 , HNO 3 и др.).
Калциевите и магнезиевите хидрокарбонати Ca(HCO 3) 2, Mg(HCO 3) 2 и карбонатите CaCO 3, MgCO 3 показват карбонатна твърдост. При нагряване на водата карбонатната смес се разрушава (променя се на 2), в резултат на което хидрокарбонатите се превръщат в карбонати.
Разликата между калциевите и магнезиевите карбонати е значително по-малка от тази на хидрокарбонатите, следователно с вряща вода твърдостта намалява. Твърдостта на водата, съставена от калциеви и магнезиеви хидрокарбонати, се нарича карбонатна. Карбонатната твърдост често се комбинира с конвенционалната твърдост, но е невъзможно да ги приравним един по един. При висока концентрация на магнезиев хидрокарбонат във вода, разликата между карбонатната и конвенционалната твърдост може да бъде значителна. Стойността на относителната твърдост практически избягва съдържанието на влага във водата, която съдържа вместо хидрокарбонати на почвените метали (Ca, Na, Mg, K) и други соли на слаби киселини. Съдържанието на влага във водата е важно за процеса на коагулация на водата по време на пречистването. Разликата между законната и конвенционалната жестокост се нарича постоянна жестокост, той е свързан с голямо количество калций и магнезий, свързани с други аниони в допълнение към хидрокарбонатите (Cl, SO 4, NO 3 и т.н.).
Твърдостта на водата е един от основните критерии за твърдостта на питейната вода. Твърдата вода не е подходяща за държавни цели: зеленчуците, месото и домашните птици се варят в твърда вода. външен вид, вкуса и сладостта на чая, е лошо да се пие сладко, тъй като натрият в него се заменя с калций и магнезий във водата, в резултат на което се образува утайка от съдържание на калций и магнезий. Твърдата вода може да причини гадене и суха кожа; В нагревателните устройства в системите за захранване с топла вода твърдата вода създава незначителна утайка, което усложнява тяхната работа.
Що се отнася до здравето, високата горчивина може да се счита за един от факторите, които допринасят за развитието на уролитиаза, както беше казано по-горе. През следващите три часа ще се обсъжда храненето, за да се влее лакомия в сърдечно-съдовата система; Има данни за смъртността от сърдечно-съдови заболявания поради консумацията на мека питейна вода. Тази хипотеза не е потвърдена в много страни.
Той навлиза в невидима част от създадения организъм и се използва за стимулиране на дихолични ензими (хемоглобин, каталаза и др.). Може да се види как напуска тялото през червата. Тялото задоволява нуждите си в стаята главно като живее със заобикалящата го среда, което е колко голямо е да влезе в тялото с пия вода, няма реално физиологично значение. Освобождаването на Fe(2+), Fe(3+) става във всички природни води при различни концентрации. При високи концентрации във водни обекти резултатът е събиране на отпадъчни води. Когато водата се разпределя през стоманени (непоцинковани) тръби, вместо да навлиза в нея, в резултат на това се увеличава корозията. Токсичният ефект от поглъщането върху тялото е неизвестен. Когато се прилага перорално, се използват по-големи дози (300 mg/kg или повече) за предотвратяване на гастроентерит без признаци на интоксикация. Следователно присъствието на вода в близост до водата не се дължи на естетическото и ежедневно дразнене, така че придава на водата каламутност, подготовка и горчив метален вкус. В допълнение, повишените концентрации на соленост във водата насърчават развитието на слюнчени бактерии; когато водопроводните тръби изчезнат, се натрупва тежка утайка, която променя диаметъра им. Установено е, че повишаване на бистротата и цвета на водата се получава при вливане както на кисели, така и на оксидни течности, като във всички случаи вонята се дължи на наличието на хидроксид в течността. Когато концентрацията на водата се промени на 0,3 mg/l, бистротата и цветът на водата са равни на стандарта. Металният вкус на водата се появява при концентрация 0,5 mg/l. Въз основа на метода на експериментиране с населението е ясно, че при значително по-голям капацитет на инфузия (над 1,0 mg/l) водата може да причини различни ефекти върху кожата на човек, включително сърбеж и сухота.
За да се приведе цветът на водата до необходимия стандарт, в пречиствателните станции се използват специални методи за оцветяване на цвета на водата. За да се заменят сулфати, хлориди и други соли във водата, водата се обезсолява чрез допълнително добавяне на различни соли. Обезсоляването се извършва с помощта на методите на дестилация, йонообмен и електродиализа. В съзнанието на местното водоснабдяване се използва методът на замразяване с естествен студ и замразяване на парчета.
За дезинфекция на вода се използват следните методи: аериране (окисляване) и накисване с допълнително извлечен хидроксид от течността, която е отстранена, чрез престояване и филтриране: а също така використна коагулация на водата и катионизация.
За омекотяване на водата (трайно или частично отстраняване на водните катиони Ca(2+) и Mg(2+) се използват реагентни методи, базирани на третиране на вода с реагенти, които се комбинират с калциеви и магнезиеви йони - практически незаменими вещества, които попадат под обсада (заради което е необходимо да се добавят гасени пари, когато се комбинират със сода). По-практиченСлед като също така е възприел йонообменния метод за омекотяване на водата от йонообменните смоли. Омекотяването на водата чрез йонообменния метод може да се извърши с помощта на вани с N-катиони, вани с Н-катиони, паралелни или последващи вани с N-Na-катиони.
При санитарно-химичния анализ на водата важна роля играе концентрацията на амонячни соли, азотни и азотни киселини (нитрити и нитрати), което е косвен показател за замърсяване на водата с органични отпадъци.
Органичните вещества от сътворената природа, които се намират във водата, подлежат на разграждане, а минерализацията възниква поради наличието на микроорганизми, които обитават водата. Този процес протича по-интензивно при топло време и поради наличието на киселина във водата. Минерализацията на азотсъдържащите органични вещества протича в две фази. В първата фаза, която се нарича амонификация, протеините и веществата се разпадат на аминокиселини и соли. Разграждането на протеините става под въздействието на анаероби (B.putrificus, B.sporogenes и други), факултативни анаероби (B.micoides и други) и аероби (B.mesentericus, B.subtilis и други). Амонификацията на семето се причинява от уробактерии и микроби. Остатъците от амоняк са продукт от кочан, чието присъствие говори за прясна органична ферментирала вода.
В друга фаза на минерализация - нитрификация - амонякът и солите се окисляват до нитрити (с помощта на B.nitrosomonas), а миризмите се окисляват до нитрати (с помощта на B.nitrobakter). За възстановяване на амониеви соли с нитрит е необходимо да се потвърди, че водата наскоро е била замърсена с органични вещества. Нитратите са крайният продукт на минерализацията на органичните съединения и тяхното наличие е индикатор за дълготрайно замърсяване на водата.
Азотните съединения ни позволяват да установим наличието на замърсяване на водата и ще има информация за възрастта на замърсяването. По този начин, ако наличието на амоняк във водата по време на многократни анализи вече не се увеличава, е възможно да се направи заключение, че водата е замърсена и вече не се замърсява. Едновременно с амоняка във водата се появяват и нитрити, което говори за системно замърсяване на водата в последно време. И ако във водата има амоняк, нитрити и нитрати, това означава изключително неблагоприятен воден резервоар, тоест дългогодишен и постоянно замърсен воден резервоар.
Ако водата показва нитрати, амоняк и нитрати всеки ден, това означава, че процесите на минерализация на органичните вещества са завършени и следователно примесите са елиминирани.
Трябва да се отбележи обаче, че замърсяването на водата с потоци от органични отпадъци не е единствената причина за появата на азотсъдържащи потоци във водата. В чистите води, които се намират на дълбочина, вкисването може да се появи всеки ден, при което се създават промивки за обновяване на минералните отпадъци от нитрити и амоняк. Този тип повишаване на концентрацията на солен амоняк и нитрити в дълбоки междупластови води не показва обструкция. Други признаци на запушена вода ще се появят през целия ден.
Амониеви соли, нитрити и нитрати във вода, напоена с вода, могат да бъдат продукти на разлагане и са продукти на разлагане на органични вещества от водно отлагане. Веществата, съдържащи азот, могат да бъдат загубени от водоснабдяването чрез промишлени отпадъчни води, както и от отпадъчни води от райони, които са явно наторени с вещества, съдържащи азот.
По този начин, за правилна хигиенна оценка на наличието на азотни съединения във водата, е необходимо да се установи причината за появата им във водата. За примесите на органични вещества във водата може да се говори по-благосклонно от факта, че успоредно с минералните азотсъдържащи съединения във водата се появяват и други показатели за примеси: химични (висока степен на окисление) и микробиологични (ниско количество, високо количество). U вода от чешмата, които могат да бъдат незамърсени, амониеви соли и нитрити като косвени индикатори за епидемиологични проблеми във водата губят своето значение. Проте, в чешмяна вода, която не е замърсена с хлор, вместо с амониеви соли концентрацията не трябва да надвишава 0,5 mg/l, т.к. чрез добавяне на по-малко активни вещества - хлорамини, хлорният витрат за инфекция се увеличава 2-4 пъти.
В местните водоизточници, съгласно установените хигиенни норми, се допуска амониев солев азот до 0,1 mg/l, нитритен азот - до 0,002 mg/l. В резултат на активността на минерали или водорасли, те са значими като индикатори за запушване и е позволено да се използват вместо вода.
От независим интерес е загубата на нитрати, които причиняват метхемоглобинемия при високи концентрации на воня. Според сегашната теория за нитратите в червата, хората продължават да нитрират под притока на бактерии, които се колебаят в новата. Овлажняването на нитритите се извършва до стабилизиране на метхемоглобина. По този начин заболяването се основава на същия стадий на кисело гладуване, чиито симптоми се проявяват първо при деца, особено в гърдите, което е важно в случай на индивидуално приготвяне (разреждане на сухи млечни смеси с вода, за да се смеси изразходване) или когато се консумира, цената на водата за пития. По-големите деца и възрастните са по-малко податливи на заболяване, тъй като имат по-силно изразени компенсаторни механизми. Концентрацията на нитрати е равна на 45 mg/l (когато се преобразува в NO 3) и безопасно се приема като GDC в питейната вода. Високите концентрации на нитрати се откриват главно в подпочвените води, като наследство от постоянна водна обструкция (особено подземни води) и минерална промяна във връзка с геохимичните характеристики на водните скали. Във вода, напоена с вода, концентрацията на нитрати като правило не е висока, а останалата воня е свързана с воден мъх. Виновникът може да бъде появата на масово замърсяване с вода и отпадъчни води, което ще предотврати нитратите.
Нитритите, като нестабилни съединения, не се натрупват във вода в токсични концентрации, така че нямат значение като метхемоглобин-съдържащ хидроксид.
Една от най-важните причини за зъбния кариес е липсата на флуор в питейната вода и в резултат на това липсата на флуор в организма. Пазете се от прякото присъствие на флуор в питейната вода и риска от зъбен кариес. Флуоридът, заедно с калций и фосфор, ще осигурят твърдостта и мекотата на четките и зъбите.
Флуорът има хематогенен ефект след накисване сциликоинтестинален тракт. От една страна, флуоридът стимулира процеса на минерализация на зъба, от друга страна, в резултат на флуоропатит, той променя структурата на твърдите тъкани на зъба, като по този начин повишава тяхната устойчивост на химични и биологични кариесогенни фактори, които действат при устата е празна.
В повърхностните води концентрацията на флуорни йони е важна до 0,5 mg/l, а водата от тези води е използваема за повечето средни и големи места. Оптималната концентрация на флуор в питейната вода е от 0,7 до 1,2 mg/l. Ниските концентрации на флуорид увеличават тежестта на кариеса. Излишъкът от флуор (над 1,5 mg/l) води до флуороза, която засяга репродуктивното здраве, особено на памука. Достоверна е честотата на респираторните заболявания и високите концентрации на флуор.
При съдържание на флуор под 0,5 mg/l се препоръчва флуориране на чешмяна вода, което намалява заболеваемостта от зъбен кариес с 65-70%. Струва си да се помни, че абсорбцията на флуорид от водата е 20% по-бърза, отколкото от продуктите, което гарантира внимателна инсталация преди флуориране на водата. При сегашното флуориране на водата съдържанието на флуор в нея е между 70-80% от максимално допустимото ниво за климатичния район на кожата. Когато флуорът присъства над морското равнище, във водата може да настъпи дефлуоризация.
Сместа от химични елементи и соли, типични за съхранението на естествена вода в питейната вода, може да съдържа налични химикали и вещества, които се губят в промишлени и селскостопански води, както и излишна течност и потоците, които се добавят към водата в рамките на един час след вземането на пробата в пречиствателни станции за вода. За тях е създаден GDK, както е представено в SanPiNs. Един от тези елементи е излишният активен хлор, който се добавя към незамърсената вода. За постигане на ефекта на незамърсяване се добавят хлорсъдържащи препарати в малки количества, така че след 30 минути контакт с вода и хлор (достатъчно за намаляване на вегетативните форми на микроорганизмите) във водата има известен излишък ( излишък във вода) между 0,3 и 0,5 mg/l. Големите количества ще добавят неприятна миризма към водата, особено поради наличието на феноли във водата и наличието на халогенирани въглехидрати, които могат да бъдат канцерогенни.
| Статистика по темата: | |
|
Избираме ролетни щори за прозорци на балкони и лоджии
Щорите на балкона са оптималното решение за тихо и ежедневно жилищно пространство... Не-турбо коралов цвят в интериора Интеграция на синьо и корал в интериора
И един от тези цветове, от които можете да постигнете страхотни... Засаждане и гледане на рододендрон Канадски рододендрон засаждане и гледане
В чуждестранната литература рододендроните се отнасят към група растения за отглеждане. | |