Choisissez des lecteurs
Statistiques populaires
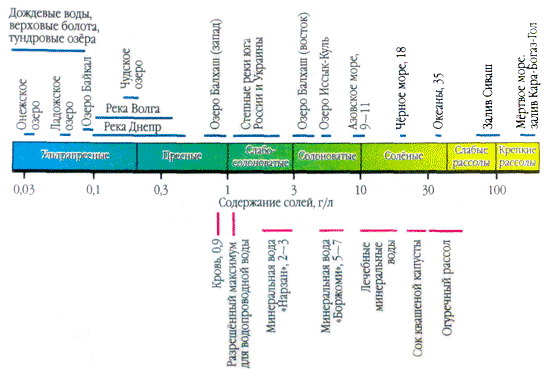
Si vous appliquez une goutte d'eau naturelle sur la surface et la frottez jusqu'à ce qu'elle s'évapore, une séparation blanche sera visible à la place de la goutte - et les sels présents dans l'eau cristalliseront. La présence de sels dans les eaux naturelles est multipliée par plusieurs. Par exemple, un litre d’eau de pluie contient une ou plusieurs dizaines de milligrammes de sels. Et dans un litre d'eau de la crique de Kara-Bogaz-Gol (mer Caspienne) - 300 g, peut-être un tiers de la masse.
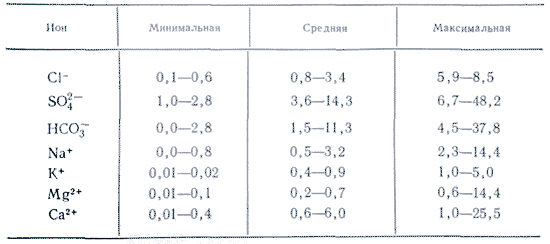
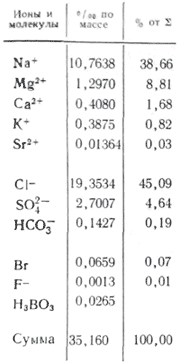
Dans les applications dans l'eau, davantage de sels sont importants sous forme d'ions. Dans les eaux naturelles, trois anions sont importants ( hydrocarbonate HCO 3 -, chlorure Cl -і sulfate SO 4 2-) et plusieurs cations ( calcium Ca 2+, magnésium Mg 2+, sodium Na+і potassium K+) - ils sont appelés ions de tête. Les ions chlorure ajoutent un goût salé à l'eau, les ions sulfate, les ions calcium et magnésium sont amers, les ions hydrocarbonates ne sont pas savoureux. Les odeurs dans les eaux douces représentent plus de 90 à 95 % et dans les eaux hautement minéralisées, plus de 99 % de toutes les rivières. La limite inférieure de concentration pour les ions principaux est de 1 mg/l, donc dans certains cas, par exemple pour la mer et certaines eaux souterraines, Br - , B 3+ , Sr 3+ etc. peuvent également être ajoutés aux composants principaux. L'ajout d'ions K + au nombre d'ions de la tête et du dos. Dans les eaux souterraines et de surface, ces ions occupent généralement une position différente. Seuls les ions K+ présents dans les retombées atmosphériques peuvent jouer un rôle majeur.
La forme protéionique des principaux composants du pouvoir est toujours bénéfique aux eaux peu minéralisées. Lorsque la concentration entre les ions augmente, il y aura alors une interaction, une association directe. processus, dissociation inverse. Dans ce cas, des paires d'ions associées sont créées, par exemple MgHCO 3 + CaHCO 3 + .
Avec l'afflux de facteurs climatiques et autres, le stockage chimique des eaux naturelles change et produit des modèles caractéristiques, certains spécifiques à différents types d'eaux naturelles (retombées atmosphériques, rivières, lacs, eaux souterraines).
Retombées atmosphériques Toutes les eaux naturelles sont les moins minéralisées, mais derrière le stockage chimique de leurs substances, la puanteur n'est pas moins variée que les autres eaux naturelles. L'entrepôt de Jerelom est constitué d'aérosols de l'atmosphère. L'entrepôt a une variété de types différents. Lorsqu'il y a une minéralisation riche moyenne des retombées atmosphériques dans la partie européenne de la Russie dans la plage de 10-20 mg/l et des valeurs extrêmes pour l'ensemble du territoire 3-4 et 50-60 mg/l d'ions Cet entrepôt est caractérisé par stringence, et les anions du milieu sont les plus importants SO 4 2- ou HCO 3 - , et le milieu des cations est maintenu au niveau de la distance pour économiser Ca 2+ ou Na +. Afin d'éviter le vent de la mer, en raison de l'élimination mécanique des sels par le vent, la concentration de chlore dans les déchets est augmentée. En raison de la conservation, la concentration dans l'eau de Cl - diminue, tandis que SO 4 2-, Ca 2+ et Mg 2+ augmentent cependant. La raison du mouvement au lieu de SO 4 2- et Ca 2+ est l'enrichissement de l'atmosphère en aérosols de mouvement continental. À mesure que la planète s’enfonce plus profondément dans le continent, une partie des aérosols marins est emportée. La concentration de SO 4 2- présente les changements les plus importants. Si l'ajout de Ca 2+ et Na + est lié avec une scie minérale des sols et des pores, à la surface de laquelle du sel est toujours présent, alors l'ajout de SO 4 2 est placé d'un côté, l'oxydation du SO 2 et H 2 S, sinon - la montée des sels acides des surfaces salines.
Il est impossible d'estimer le grand nombre de particules de sel qui s'élèvent des sols, des lacs salés, de la surface des glaces, des fertilisants et des substances à feuilles caduques qui sont libérées sous forme de substances chimiques et métallurgiques. Elles sont rejetées dans l'atmosphère à la suite d'autres activités humaines, puis emportés par les retombées.
Arrosez la majeure partie de la rivière allongez-vous à la classe des hydrocarbonates. Derrière le stockage des cations, cette eau peut également contenir du calcium ; Les eaux hydrocarbonées à forte concentration en magnésium et en sodium sont même rares. Les eaux naturelles de la classe des hydrocarbonates contiennent la plus grande quantité d'eau à faible minéralisation (teneur totale en sel jusqu'à 200 mg/l).
Les rivières dont l'eau atteint la classe des sulfates sont presque innombrables. La puanteur est plus large, surtout dans les smoothies des steppes et souvent dans les smoothies vides. Dans le stockage des cations dans les eaux naturelles de la classe des sulfates, comme dans les eaux de la classe des hydrocarbonates, le calcium prédomine. Cependant, un certain nombre de rivières de la classe des sulfates sont surpondérées en sodium. Selon la minéralisation des eaux de la classe des sulfates, il est important de dépasser les eaux de la classe des hydrocarbonates. Les eaux sulfatées des rivières à faible minéralisation (teneur en solides jusqu'à 200 mg/l) et moyenne (teneur en solides de 200 à 500 mg/l) augmentent rarement de manière uniforme. La caractéristique la plus caractéristique de cette rivière est qu'elle est faible (la teneur en sel est de 500 à 1000 mg/l) et élevée (la teneur en sel est supérieure à 1000 mg/l) de minéralisation de l'eau.
Les rivières dont les eaux atteignent le niveau de chlorure se forment aussi rarement que les rivières dont les eaux contiennent des sulfates. Devant ce territoire se trouvent les régions steppiques les plus importantes, mais en vain. Les cations les plus importants des eaux naturelles sont de la classe des chlorures, principalement le sodium. Les eaux de la classe des chlorures ont une minéralisation élevée - supérieure à 1 000 mg/l, supérieure à 500 à 1 000 mg/l.
Les caractéristiques du stockage ionique de l'eau de rivière sont réalisées jusqu'à la période estivale. Jusqu'au monde du chant, il caractérise l'entrepôt et pendant l'heure de la cascade de glace. Cela signifie que moins de minéralisation de l’eau est évitée au printemps.
Il existe une tendance cohérente dans la répartition du stockage d'ions dans l'eau des rivières en Russie. Il existe une tendance générale à une minéralisation accrue de l'eau sur le territoire plus vaste de la partie européenne de la Russie, de jour en jour et dès le début de la descente. La zonalité du stockage ionique des eaux fluviales s’explique par l’action des esprits soucieux du climat du temps présent et par le climat du passé. Le niveau d'humidité des sols et des roches, la présence de sels facilement volatils et la salinité des sols sont le résultat naturel de l'afflux riche de différents esprits climatiques. Détruire le zonage de l'entrepôt chimique de l'eau du fleuve de Russie et l'importance de l'entrepôt des espèces et des esprits de leur contamination.

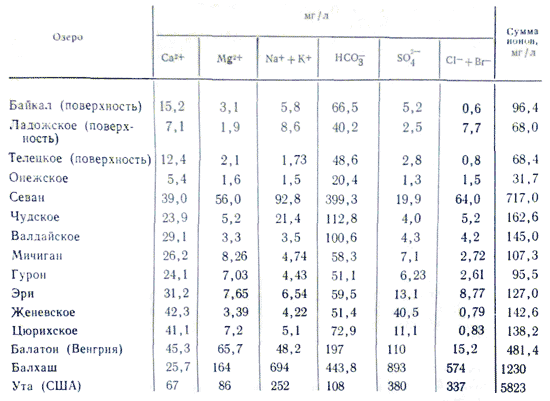
Minéralisation et stockage chimique de l'eau du lac Le changement de rivière en rivière change à des frontières très larges. Les rivières avec une minéralisation de l'eau supérieure à 100-200 mg/l, pour une raison quelconque, il y a eu des puants, sont un phénomène rare, tandis que la minéralisation de l'eau du lac est même faible, plusieurs dizaines de mg/l (montées totalement faibles depuis la planche) à très élevé 3 -3,5% (lacs salés avec saumure de rose jusqu'au bord infusée de sels). La teneur en minéralisation est influencée par le stockage d'ions dans l'eau du lac. Personne ne connaît les lois, l'énergie et le stockage chimique de l'eau des rivières. Avec une minéralisation accrue de l'eau du lac, il y a une augmentation rapide des ions dans son stockage dans l'ordre suivant : HCO 3 - →SO 4 2- →Cl - ; Ca 2+ →Mg 2+ →Na + . Lorsque la minéralisation atteint 500-1000 mg/l dans l'eau du lac, les ions hydrocarbonates prédominent, au-dessus de 0,1% - le plus souvent des ions sulfates, et après avoir atteint 0,3-0,5%, selon les caractéristiques lithologiques de l'eau. eau douce - eau sulfate ou chlorure . Dans le stockage des cations dans les eaux des lacs, le rôle du calcium est important : moins de 0,1 à 0,2 % sont économisés. À mesure que la minéralisation augmente, le sodium commence à jouer ce rôle. Elles retiennent le magnésium, comme toutes les autres eaux, en position intermédiaire lors de toutes les minéralisations. La raison de cette division de la composition ionique réside dans les différents types de sels. La partie la plus importante des lacs frais, tels que les rivières, est derrière le stockage des eaux hydrocarbonées-calciques.
action eau de mer caractérisé par une grande quantité de sels. Dans les eaux continentales, on observe le plus souvent les rapports de concentrations suivants : HCO 3 -> SO 4 2- > Cl - et Ca 2+ > Mg 2+ > Na + ou Ca 2+ > Na + > Mg 2+, puis pour les eaux saumâtres et les eaux de mer, à partir de la minéralisation halal de 1 g/kg, le rapport change : Cl -> SO 4 2- > HCO 3 - et Na + > Mg 2+ > Ca 2+. Le changement dans la relation entre les eaux fluviales et les eaux marines s'explique par les progrès récents de l'importance des sels de faible qualité dans un monde de minéralisation accrue de l'eau. Au total, eux et la moitié des principaux composants représentent 99,99 % de tous les composants de l'eau océanique et des flux minéraux.
Entre les éléments du principal entrepôt de sel de l'eau de mer, entre la peau et leur somme, il y a de l'acier pratique en termes de concentration. Restant yogo dov U. Ditmar, vykonav nouvelle analyse chimique (chlorures, sulfates, calcium, magnésium, sodium) 77 échantillons d'eau livrés de tous les océans à différentes profondeurs de l'expédition sur le "Challenger" : dans l'eau en haute mer indépendamment de la concentration absolue de dioxyde de carbone entre les principaux composants du principal entrepôt de sel est toujours constante (loi de Dittmar). PID avec le Viparovvannya Vyparovvannya, matité, tannna terne lodiv sabbats les poux des sels, la sole de la guimauve, ale -ahled à Morskiye, l'étranger dans les intergles n'est pas pour que l'immensité de l'immensité ne serpente pas. Un tel rang, yakshcho vіdomo, est le temps des sels nitreux de Kilkosti que je concentre, les composants de base de 1 kg d'eau avant les concentrés du même Ingredi, le lichen pour l'un des cultes est capable de calculer l'entrepôt de salut du lecteur Oceansko. Dans le cadre d'un tel ingrédient « de référence », il y a la « chlorinité », qui correspond à plusieurs grammes d'ions chlore, équivalents à la quantité d'halogènes (y compris les fluorures, qui ne sont pas précipités par les nitrates) devant être présents dans 1 kg d'eau de mer. (attribué à Sorensen). La stabilité du stockage de l'eau océanique est facilement détruite par l'afflux de ruissellement continental, qui se rafraîchit, dans les zones estuariennes et à proximité des mers intérieures où les échanges d'eau avec l'océan sont difficiles. Dans l'entrepôt des composants principaux, la concentration en cations calcium et magnésium, ainsi que la somme des concentrations d'anions d'acides faibles (HCO 3 -, CO 3 2-, H 2 BO 3 -) sont nettement inférieures de 1 % dans la stabilisation de sp Ajouté à la liaison avec le carbonate de calcium dérivé de l'eau dans les boules de surface et à la dégradation de l'eau sur l'argile.
La concentration de microéléments dans le comprimé est faible, de sorte que la quantité de puanteur dépasse 0,01 % en poids de tous les sels dissous. De l'alarme de fond de ligne V.V. Gordeva et A.P. On retrouve la lysicine, dans laquelle les concentrations les plus élevées comprennent le lithium (180 µg/l), le rubidium (120 µg/l), le baryum (18 µg/l), les plus faibles - l'or (0,004 µg/l), les éléments des terres rares (moins supérieure à 0,001 µg l) de radium (10 -7 µg/l).
Plus la mer est isolée de l’océan, plus le stockage de son eau diffère du stockage de l’eau dans l’océan. L'échange d'eau avec l'océan, la relation entre le volume du ruissellement continental et le volume de la mer, la profondeur de la mer et la nature du stockage chimique de l'eau dans le fleuve qui s'y jette sont d'une importance primordiale.
Eaux souterraines Ils sont dérangés par les couleurs violettes de l'entrepôt chimique et de l'entrepôt ionique. Le stockage de l’eau se décline dans toutes les classes et groupes de types. Le premier réservoir d'eaux souterraines est le premier à être stocké dans l'esprit de leur formation et de leur contamination.
L'eau naturelle a tendance à maintenir la valeur du pH moins stable, car elle réduit fortement l'acidité de l'acide ou de la base. Si vous ajoutez une goutte d'acide chlorhydrique concentré à un litre d'eau distillée, le pH passera de 7 à 4. Si vous ajoutez une goutte d'acide chlorhydrique à un litre d'eau de rivière dont le pH = 7, la valeur du pH peut changer. Les acides et les bases qui consomment de l'eau naturelle sont neutralisés par le dioxyde de carbone et les ions hydrocarbonates qui y sont dissous :
H + + HCO 3 - ↔ H 2 O + CO 2
OH - + CO 2 ↔ HCO 3 -
Les ions carbonate neutralisent les acides qui se perdent dans l'eau par dépôt atmosphérique ou se forment en raison de la vitalité des organismes. La résistance à l’eau et aux acides acides est directement liée à la concentration en ions hydrocarbonates. Les rivières les plus sensibles à ceux-ci sont les lacs de Carélie, de Finlande et de Scandinavie : il n'y a pratiquement pas de tels ions dans leurs eaux.
Une rivière organique d'eaux naturelles est un complexe de rivières de réservoirs organiques véritablement désintégrées et bien formées. Selon la situation, les rivières organiques d'eaux naturelles peuvent être divisées en celles qui coulent de la zone de drainage et sont établies à proximité du plan d'eau. Au premier groupe se trouve la majeure partie des mélanges d'humus, qui sont lessivés avec l'eau des sols, la tourbe, l'humus forestier et d'autres types de solutions naturelles, qui comprennent les surplus de plantes, et les substances organiques provenant de l'industrie et du gouvernement. Eaux usées. Parmi les acides humiques destinés à l'hydrochimie, les acides humiques et fulviques présentent le plus grand intérêt. Les acides offensants sont caractéristiques de l'humus (acide humique), la puanteur n'existe pas dans les tissus vivants végétaux et animaux. La relation entre eux dans différentes tourbes et sols est différente. Dans les sols de terres noires, les acides humiques sont plus importants, et dans les sols podzoliques, les acides fulviques sont plus importants.
La concentration de matière organique dans les eaux naturelles, variant sur de larges intervalles, est la plus élevée dans les eaux des marais (qui, avec une forte concentration de matière humique, atteint parfois 500 mg/l ou plus) et les rivières avec des tavernes des marais, et l'eau des marais est entaché par le marron jusqu'à 300° et au-dessus de l'échelle de couleur platine-cobalt (l'ajout d'eau naturelle ajoute des acides humiques). Une forte concentration d'inode de parole organique est concentrée dans eaux souterraines, associés aux gisements contenant du naphta. Des concentrations encore plus élevées peuvent être présentes dans les eaux naturelles contaminées par les eaux usées industrielles et domestiques. Les eaux naturelles non polluées entraînent un écoulement de peu de matière organique. Par exemple, pour B.A. Skopintsev, dans l'eau de mer, la concentration de matière organique devient inférieure à 2,0-5,4 mg/l (en moyenne 3,0 mg/l et dans l'eau des rivières en moyenne 20 mg/l).
Dans certaines eaux de surface, notamment dans les rivières des marécages, les dépôts d'humus constituent l'essentiel de la composition chimique de l'eau. Une fois que les rivières, puis les lacs et les mers sont bien aérés, les parties organiques de l'eau sont sujettes à changement, et dans les sols, le processus d'oxydation s'achève en grande partie par une transition de la simple matière minérale. L’autre partie, persistante, se perd et s’accumule dans les plans d’eau.
Dans les zones climatiques froides (toundra), il y a très peu d'excédents organiques et les réservoirs d'eau ne peuvent pas contenir d'acides humiques. Et dans la zone des forêts, notamment de conifères, où les résidus organiques sont abondants et où les puanteurs ne se dissolvent pas en surface, à la place des acides humiques, il y a plusieurs dizaines de milligrammes par litre. Les acides humiques acidifient non seulement l'eau du réservoir, mais lient également presque tous les métaux importants du complexe.
Lorsque vous versez de l’eau froide du robinet dans une bouteille et que vous la placez dans un endroit chaud, des bulles de gaz apparaîtront sur les parois. Gazi a été détruit en eau froide et étaient visibles lorsqu'ils sont chauffés (la concentration des gaz change lorsqu'ils sont chauffés). Il s'agit de gaz acide, d'azote et de dioxyde de carbone. L'intensité du gaz dans l'eau a tendance à diminuer avec l'augmentation de la température, qui est associée à l'augmentation de l'énergie cinétique des molécules de gaz, ce qui réduit les forces gravitationnelles des molécules d'eau. Toutes les eaux naturelles représentent des sources de gaz. L'oxygène O 2 et le dioxyde de carbone CO 2 sont les plus abondants dans les eaux de surface, et l'oxygène H 2 S et le méthane CH 4 sont les plus abondants dans les eaux souterraines. En quantités importantes, le CO 2 peut également être présent dans l'eau des horizons profonds. De plus, toutes les eaux naturelles contiennent en permanence de l’azote N2.
Kisen (O2) trouvé dans l’eau naturelle sous l’apparence de molécules brisées. Kisen, étant un agent oxydant puissant, joue un rôle particulier dans la formation du stockage chimique des eaux naturelles. Le Kisen provient de l'eau et résulte des processus de photosynthèse qui se produisent dans la nature et dans l'atmosphère. Kisen est utilisé pour l'oxydation des substances organiques, ainsi que dans le processus de dégénérescence des organismes. La concentration d'acide dissous dans les eaux naturelles varie entre 0 et 14 mg/l, avec une photosynthèse intense, cette dernière étant possible et des concentrations plus élevées. En raison de la concentration à long terme d'acide dans les eaux de surface en raison de faibles facteurs, sa concentration change considérablement avec la durée de production, la saison et le devenir. Il est peu probable que les restes de l'acidité morte soient laissés sur place en raison des changements dans le rayonnement solaire, et la photosynthèse en dépend entièrement ; à mesure que la journée avance, l'acidité s'accumule et l'heure sombre permet de la consommer. L'acide est nécessaire à la destruction de la plupart des organismes qui habitent les eaux. En tant qu'acide oxydant fort, il joue un rôle sanitaire et hygiénique important, favorisant la minéralisation rapide des excédents organiques.
Dioxyde de carbone (CO2)être en charge de l'eau afin de voir la décomposition des molécules en gaz CO2. Cependant, une partie (environ 1 %) interagit avec l'eau, solubilisant l'acide carbonique :
CO 2 + H 2 O ↔ H 2 CO 3
Assurez-vous de ne pas ajouter autant de CO 2 et de H 2 CO 3 que de dioxyde de carbone (CO 2 + H 2 CO 3). Dans les eaux naturelles, le dioxyde de carbone est présent avant le processus d'oxydation des substances organiques, provoqué par la présence de CO 2 tant dans l'eau que dans les sols et les surfaces sur lesquels l'eau coule. Devant eux, on peut entendre le souffle des organismes aquatiques et différents points de vue décomposition biochimique et oxydation des surplus organiques. Dans certaines eaux souterraines, il existe une source importante de dioxyde de carbone et de gaz volcaniques visibles au-dessus du sol, dont l'apparition est associée au dégazage du manteau et aux processus complexes de métamorphose des pores sédimentaires qui s'y produisent. l'argile sous l'afflux haute température. C’est pourquoi les niveaux élevés de dioxyde de carbone sont souvent évités dans les eaux souterraines et les réservoirs argileux. Le rejet de dioxyde de carbone de l’atmosphère par l’eau est plus important pour les eaux marines et océaniques et moins important pour les eaux terrestres. Le remplacement du dioxyde de carbone par du dioxyde de carbone se produit lors de la photosynthèse. Même avec une photosynthèse intense, s'il y a une diminution du CO 2 sous forme gazeuse, les ions restants peuvent être vus à partir des ions HCO 3 :
HCO 3 - ↔ CO 3 2- + CO 2
Le dioxyde de carbone est également utilisé pour décomposer les carbonates :
CaCO 3 + CO 2 + H 2 O ↔ Ca(HCO 3) 2
La vitrification chimique des aluminosilicates est également utilisée. Une modification du CO 2 dans l'eau, notamment dans les eaux de surface terrestres, est également observée lors de son rejet dans l'atmosphère. L'atmosphère brûlante de CO 2 est d'une grande importance pour le CO 2 qui réside dans les eaux de surface, car elle y régule son activité. Entre l'atmosphère de CO 2 et les eaux de surface du CO 2, il y a un échange continu, dirigeant l'établissement d'un équilibre égal entre elles, basé sur la loi de Henry-Dalton. La pression partielle du dioxyde de carbone dans l'atmosphère est très faible (33 Pa), donc, quelle que soit sa grande force (à une pression de 1013 hPa et une température de 12 °C jusqu'à 2166 mg/l), le reste entre l'eau et l'atmosphère est atteint avec très peu de mu avec le CO 2 dans l'eau. À une pression partielle de CO 2 dans l'atmosphère de 33 Pa, sa concentration dans l'eau sera de 2166,0,00033 = 0,715 mg/l (à 12 °C). En raison des eaux de surface du sol, dans lesquelles se déroulent divers processus de décomposition de la matière organique et des sols, une plus grande quantité de CO 2 est évacuée et est donc rejetée dans l'atmosphère. À moins que la photosynthèse soit très forte, si le CO 2 est présent, le CO 2 peut être éliminé de l'atmosphère. Au lieu du dioxyde de carbone dans les eaux naturelles, il est extrêmement variable - jusqu'à plusieurs dixièmes de fois jusqu'à 3 000-4 000 mg/l. La plus faible concentration de CO 2 est observée dans les eaux de surface, notamment minéralisées (mer, lacs salés), la plus élevée dans les eaux souterraines et usées polluées. Dans les rivières et les lacs, la concentration de CO 2 dépasse rarement 20-30 mg/l.
Rozchinny moléculaire azote (N 2)- Le gaz le plus stable dans les eaux naturelles. L'azote le plus chimiquement stable et biologiquement important, introduit dans les boules d'argile de l'océan ou des eaux souterraines, ne change rapidement que sous l'afflux de forces physiques (température et pression). Dans le cas des eaux de surface, l'azote joue un rôle important dans l'approvisionnement en eau. Dans la nature, on observe une augmentation généralisée de l’azote biogénique, résultant de la dénitrification.
Gaz méthane (CH4) atteindre les plus grands gaz et eaux souterraines. Dans la phase gazeuse des eaux souterraines, l'azote, le dioxyde de carbone ou le méthane prédominent souvent. La principale source de création de méthane provient des composés organiques dispersés dans les roches. Le méthane, qui est important dans les glucides, est souvent présent en concentrations importantes dans les eaux souterraines profondes des structures fermées associées aux gisements contenant du naphta. En faibles concentrations, le méthane s'accumule dans les lacs naturels, où il peut être vu depuis le mulet lorsque de grands arbres sont plantés, ainsi que dans les dépôts du fond des océans dans les zones de forte productivité biologique.
Gaz Sirkovoden (H2S) C'est l'un des produits de décomposition des matières protéiques, qui est stocké dans votre entrepôt, et donc son accumulation est souvent stockée dans des boules de fond avec de l'eau en raison de la pourriture de divers excès organiques. Dans les parties inférieures des lacs et des mers profonds, où il y a un échange d'eau quotidien, une zone d'eau profonde se développe souvent. Avec une pression partielle de l'eau dans l'atmosphère inférieure à zéro, la présence d'eau dans les eaux de surface est impossible. De plus, le vin est oxydé par l’acidité, qui est dissoute par l’eau. Dans les rivières, les eaux profondes se limitent principalement aux bassins de fond, notamment pendant la période hivernale, lorsque l'aération du plan d'eau est difficile. La présence d’eau aqueuse dans les eaux de surface naturelles et non polluées est un phénomène rare. Bien plus souvent, l'eau est présente dans les eaux souterraines isolées de la surface et dans les eaux de surface très polluées, dans lesquelles les vins servent d'indicateur de contamination grave et de drainage anaérobie.
Outre ceux présents dans l'eau, de nombreux éléments : azote, phosphore, silicium, aluminium, salive, fluor sont présents à des concentrations allant de 0,1 à 10 mg/l. La puanteur est appelée mésoéléments (du grec « Mesos » - « milieu », « intermédiaire »).
L'azote sous forme de nitrates NO 3 - se perd dans l'eau et l'eau de table, et sous forme d'acides aminés, de sels (NH 2) 2 CO et de sels d'ammonium NH 4 + - lors de l'élimination des excédents organiques.
Le phosphore est présent dans l'eau sous forme d'hydrophosphates HPO 3 2- et de dihydrogène phosphates H 2 PO 3 - créés à la suite de la décomposition des excédents organiques.
Le silicium est un composant essentiel du stockage chimique des eaux naturelles. Cela est dû à la présence d'autres composants partout en présence de silicium dans les roches montagneuses, et la faible diversité des composants restants explique la teneur minimale en silicium dans l'eau potable. La concentration de silicium dans les eaux naturelles est de quelques milligrammes pour 1 litre. Dans les eaux souterraines, il monte et descend souvent jusqu'à des dizaines de milligrammes par litre, et dans les eaux thermales chaudes, jusqu'à des centaines. Outre la température, la sensibilité du silicium est fortement affectée par les changements de pH. Il y a une petite quantité de silicium dans les eaux de surface, qui est réduit en dioxyde de silicium (125 mg/l à 26 °C, 170 mg/l à 38 °C), ce qui indique la présence de processus dans l'eau qui modifient sa concentration. Avant eux, il faut introduire des organismes aquatiques riches en silicium, dont beaucoup, par exemple les diatomées, formeront leur squelette en silicium. De plus, l'acide silicique, en tant qu'acide faible, diffère de l'acide carbonique :
Na 4 SiO 4 + 4CO 2 + 4H 2 O = H 4 SiO 4 + 4NaHCO 3
Il réduit l'instabilité du silicium due à la tendance de l'acide silicique à se transformer en gel. Dans les eaux très peu minéralisées, le silicium devient une source, et parfois une partie importante de la composition chimique de l'eau, voire même pas du tout. La présence de silicium dans l'eau est un grave défaut technologique, car lorsque l'eau bouillante est complètement sèche, le silicium crée dans les chaudières un tartre de silicate très dur.
L'aluminium est présent à proximité de l'eau en raison de la présence d'acides sur l'argile (kaolin) :
Al 2 (OH) 4 + 6H + = 2SiO 2 + 5H 2 O + 2Al 3+
Le principal gisement est l'argile. Les résidus organiques (ci-après dénommés « C »), au contact d'eux, réduisent la teneur en divalents, qui sont complètement absorbés sous forme d'hydrocarbures ou de sels d'acides humiques :
2Fe 2 O 3 + "C" + 4H 2 O + 7CO 2 = 4Fe(HCO 3) 2
Lorsque l'eau contenant des ions Fe 2+ dissous entre en contact avec l'eau, elle s'oxyde rapidement, créant un précipité brun d'hydroxyde de Fe(OH) 3. Cette année, il est converti en minerai de marais - herbe brune (limonite) FeO(OH). Le minerai des marais de Carélie était extrait aux XVIIIe et XIXe siècles pour en extraire le revêtement.
Les crachats bleus à la surface de l'eau sont du Fe(OH) 3, qui se dissout lorsque l'eau souterraine contenant des ions Fe 2+ entre en contact avec la surface. Ils se perdent souvent dans le polyéthylène fondu, mais il est très facile de les couper : l'hydroxyde fondu cicatrisera les bords déchirés. Une fois le liquide à la surface de l’eau, pressez l’hydroxyde fondu dans un carter d’huile, afin de ne pas déborder.
Ce groupe comprend des éléments que l’on trouve dans les eaux naturelles en très petites concentrations, c’est pourquoi on les appelle microéléments. Leur concentration varie en microgrammes pour 1 litre (mcg/l) et a souvent des valeurs plus élevées. Les microéléments constituent le plus grand groupe d'éléments dans la composition chimique des eaux naturelles ; ils comprennent tous les éléments du système périodique qui ne sont pas inclus dans les groupes de composants précédents considérés. Ils peuvent être mentalement divisés en cinq sous-groupes : 1) cations typiques (Li +, Rb +, Cs +, Be 2+, Sr 2+, Ba 2+ et ainsi de suite) ; 2) les ions de métaux importants (Cu 2+, Ag +, Au +, Pb 2+, Fe 2+, Ni 2+, Co 2+ et ainsi de suite) ; 3) complexes amphotères (Cr, Mo, V, Mn) ; 4) anions typiques (Br -, I -, F -) ; 5) éléments radioactifs. Les microéléments sont nécessaires à la vie normale des plantes, des animaux et des humains. Cependant, à des concentrations accrues, de nombreux microéléments sont nocifs et nocifs pour les organismes vivants. C'est pourquoi la puanteur se fond souvent en sons boueux et leur concentration est contrôlée. La culture réussie des microéléments est difficile en raison de leur faible présence dans les eaux naturelles et de la grande incertitude quant à la forme de leur présence dans les eaux. Il reste difficile d'expliquer les schémas de leur migration et leur régime, et crée des difficultés d'analyse chimique. Par exemple, beaucoup métaux importants Ils migrent en fortes concentrations vers l’état vital et non vers l’état désordonné. Les complexes organiques désintégrés créent la plupart des métaux, en premier lieu les métaux trivalents avec les acides humiques et fulviques. La concentration des métaux complexés est calculée avant la concentration des acides organiques. L'aspect des roches est riche en hydroxydes métalliques. Il est possible qu'il y ait adsorption de substances organiques à la surface des colloïdes, ce qui leur confère une plus grande stabilité de décomposition.
Entrepôt de produits chimiques L’eau naturelle signifie donc l’histoire antérieure. chemins formés par l'eau au cours de sa circulation. Un certain nombre de discours différents dans une telle eau sont déposés, d'une part, à partir de l'entrepôt de ces discours avec lesquels ils coulaient, d'autre part, à partir des esprits avec lesquels ils ont interagi les uns avec les autres. Les facteurs suivants peuvent ajouter de l'eau à un réservoir chimique : roches montagneuses, sols, organismes vivants, activité humaine, climat, relief, régime hydrique, végétation, conditions hydrogéologiques et hydrodynamiques, etc. Examinons de plus près les facteurs qui entrent en jeu dans le stockage de l'eau.
La dégradation du sol et les retombées atmosphériques, qui sont filtrées à travers le sol, entraînent la dégradation des roches et des minéraux. C'est l'une des influences les plus importantes sur le sol qui s'écoule dans l'entrepôt de moulage des eaux naturelles, entraînant une concentration accrue de dioxyde de carbone dans le sol, qui se manifeste lors du dessèchement des organismes vivants et des systèmes racinaires dans les sols et de la dégradation biochimique. des excédents organiques. En conséquence, la concentration de CO 2 dans l'air du sol augmente de 0,033 %, dans l'air atmosphérique, à 1 % ou plus dans l'air du sol (dans les sols argileux importants, la concentration de CO 2 dans l'air du sol. Le vent atteint 5 -10%, donnant ainsi une forte action agressive selon l'âge des races). Un autre facteur qui renforce l'effet agressif de l'eau filtrée à travers le sol est la matière organique - l'humus du sol, qui s'établit dans le sol lors de la transformation de l'excès de végétation. Dans le stockage de l'humus dans le récipient des réactifs actifs, il faut citer en premier lieu les acides humiques et fulviques et les substances simples, comme les acides organiques (citrique, oseille, oxtoïque, malique, etc.). L'exploitation des sols, riches en acides organiques et en CO 2, est souvent accélérée par la vitrification chimique des aluminosilicates présents dans les sols. De même, l’eau filtrée à travers le sol accélère la vibration chimique des aluminosilicates et des roches carbonatées qui se trouvent sous le sol. Vapnyak dissout facilement le carbonate de calcium de faible qualité (jusqu'à 1,6 g/l) :
CaCO 3 + H 2 O + CO 2 ↔ Ca(HCO 3) 2
Dans toute la partie européenne de la Russie (Crimée de Carélie et région de Mourmansk), les gisements, ainsi que la dolomie MgCO 3 .CaCO 3, se trouvent près de la surface. Par conséquent, il est important que l’eau contienne ici des carbonates de calcium et de magnésium. Dans les rivières telles que la Volga, le Don, la Pivnichna Dvina et leurs principaux affluents, les hydrocarbonates de calcium et de magnésium représentent 3/4 à 9/10 de tous les sels dissous.
Les sels sont consommés dans les plans d’eau et du fait de l’activité humaine. Ainsi, les routes sont arrosées de chlorures de sodium et de calcium pour faire fondre la glace. Au printemps, les chlorures s'écoulent de l'eau de fonte de la rivière. La quantité de chlorures contenue dans les rivières de la partie européenne de la Russie y a été apportée par l'homme. Près des rivières sur lesquelles se dressent de grandes places, cette partie est plus riche.
Le relief de la localité infuse indirectement un réservoir d'eau, absorbant l'élimination des sels du sol. La profondeur de l'incision érosive de la rivière facilite l'accès à la rivière avec des eaux souterraines plus minéralisées depuis les horizons inférieurs. Qui peut accueillir d'autres types de dépressions (vallées fluviales, ravins, ravins), qui améliorent le drainage du bassin versant.
Le climat crée un fond étouffant, qui permet à un plus grand nombre de processus de se produire dans la formation d'un réservoir chimique d'eaux naturelles. Le climat dépend principalement de l'équilibre entre la chaleur et l'eau, qui détermine les dépôts de sol et le volume du débit d'eau, et donc la dilution ou la concentration des perturbations naturelles et la possibilité de destruction des rivières ou de leur siège.
Il est très important d'amener l'entrepôt chimique de l'eau à un débit important et de modifier la vie du plan d'eau et ses relations au fil du temps. Pendant la période de fonte des neiges, l’eau des rivières, des lacs et des réservoirs est moins minéralisée, pendant la période où la majeure partie de la vie provient des eaux souterraines et souterraines. C'est pourquoi les meubles sont utilisés pour réguler la surface de l'eau et en éliminer l'eau. En règle générale, les bassins versants se reconstituent au printemps, si l'eau de marée est moins minéralisée.
Le stockage chimique de l'eau peut être différent et des fragments peuvent se trouver à la place de particules de substances inorganiques et organiques. En circulant à travers différentes parties de la terre, l'eau décompose les sels (calcium, magnésium, etc.) qui y sont présents.
En rotation à la surface de la terre, l'eau s'accumule avec les gaz et les dissout. Les eaux naturelles sont séparées de l'entrepôt chimique en un seul type, de sorte qu'elles soient formées de gaz, d'ions basiques, de substances biogéniques et organiques et de microéléments.
Un grand afflux d’eau et de stockage de produits chimiques est appliqué au sol et au lit. L'eau élimine les substances minérales et organiques du sol, qui est particulièrement soigneusement protégé lors des premières étapes d'exploitation.
Le régime gazeux dans les réservoirs naturels et artificiels est formé par la combinaison de gaz perdus dans l'atmosphère et à la suite de processus chimiques. Un grand nombre de gaz dissous subsistent en raison de la température, de la pression et de la présence de sels dans l'eau.
Ces gaz, et en premier lieu l'acidité et le dioxyde de carbone, sont simplement nécessaires à la vie des organismes aquatiques. Plus il y en a près de l’eau, mieux c’est pour les habitants du bassin hydrographique. Cependant, la teneur élevée en eau, en méthane et en azote réduit la vitalité des êtres vivants.
L’un des gaz les plus importants constamment présents dans les eaux de surface est le gaz acide. Une quantité importante d’eau peut être trouvée dans les eaux chimiques et biologiques.
Les dzherels de tête sont remplis d'eau aigre
- l'atmosphère - sous le vent montant, se confond avec les boules d'eau superficielles ;
- Photosynthèse d'algues microscopiques.
À haute température, l'acidité de l'eau change et à basse température, elle augmente.
L'acidité de l'eau dans les eaux naturelles est inférieure à 100 %, car le volume de ce gaz va à l'oxydation des substances organiques. Lorsqu'il y a un développement massif d'algues (au début) dans de grandes étendues d'eau, l'acidité peut atteindre 150 à 200 %.
Le dioxyde de carbone (CO 2 ) est présent en grande quantité dans toutes les eaux naturelles. Dans ce cas, la majeure partie du dioxyde de carbone est présente à l’état dissous et une petite quantité de dioxyde de carbone (jusqu’à 1 %) peut interagir avec l’eau et créer de l’acide carbonique.
L'augmentation de la concentration d'acide carbonique dans le mélange pour atteindre le niveau optimal est basée sur la concentration de substances organiques. Il est particulièrement important de réguler la production d’acidité et d’acide carbonique.
Pour déterminer la composition chimique de l'eau et la nature de son évolution, des tests en laboratoire doivent être effectués. Des informations de base sur l'acidité de l'eau peuvent être obtenues à l'aide d'un appareil spécial utilisé pour les tests. est un bloc transparent avec deux fossés et une échelle de couleurs.
En présence de ces produits chimiques et d’autres, l’eau testée développe une couleur distincte qui correspond à l’échelle de couleurs de l’échelle. L'échelle de couleur de la peau est déterminée par le niveau d'acidité de l'eau.
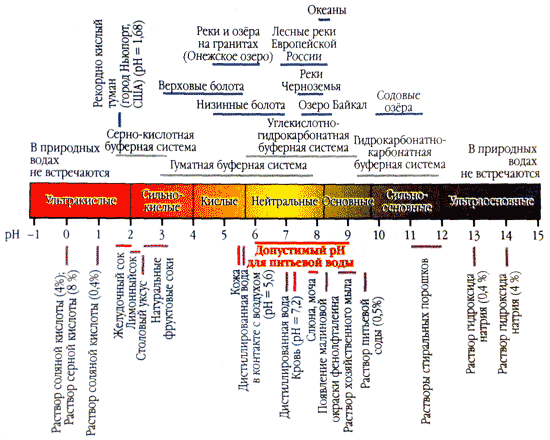
L'acidité de l'eau (pH) caractérise la réaction active du milieu. Plus la valeur du pH est proche de zéro, plus la concentration d'ions eau dans la solution est élevée, plus le milieu est acide.
L'indicateur optimal de l'acidité de l'eau pour l'homme se situe dans la plage étroite de 7,2 à 7,4, avec un maximum de 7,6. Avec un pH aussi égal, l’eau ne coule pas sur la peau humaine et empêche la prolifération des micro-organismes.
Si le pH est supérieur à 7,8, cette eau irrite la peau (particulièrement sensible) et les micro-organismes peuvent facilement se reproduire dans l'eau. En outre, haute rhubarbe Le pH favorise l'activité corrosive de l'eau, ce qui affecte considérablement l'efficacité de la possession et de la communication.
Les niveaux de pH de l'eau les plus élevés (8-8,8) sont observés dans l'autre moitié de la saison de croissance, lorsque la biomasse d'algues atteint son plus grand développement et que les processus de photosynthèse se produisent à leur intensité maximale.
À la suite de réactions chimiques comme l’eau. Le niveau de pH change progressivement, à la fois avec l'eau et avec l'eau prélevée.
La dureté de l’eau affecte grandement le niveau de pH. Oui, oui eau douce Le pH de la rhubarbe est inférieur à 7,0 et celui amer peut atteindre 9,0.
La dureté de l'eau est déterminée à la place du Ca CO2 (). Lorsque des changements de température se produisent, des sédiments tombent sur les parois de la piscine, les filtres, les échangeurs de chaleur et autres équipements.
Selon les normes, la dureté de l'eau ne doit pas dépasser 30°dH, où 1°dH = 10 mg CaO/l. La dureté de l’eau peut changer à mesure qu’elle reste longtemps. En hiver, elle diminue encore pendant la saison des pluies.
L'oxydation de l'eau est déterminée par l'utilisation de diverses substances organiques et minérales.
La quantité d'oxydation montre la quantité d'oxydation perdue lors de la destruction des substances organiques (mg/l). Au cours de la saison de croissance en cours, l'oxydation de l'eau passe de 10 à 30 mg pour 1 litre ou plus.
Entrepôt d'eau chimique. Dans la nature, il est courant que l’eau contienne toujours plus ou moins de sels minéraux. Étape entrepôt de minéraux L'eau est déterminée par la nature du ou des sols se trouvant jusqu'aux aquifères ou aux réservoirs d'eau de surface.
La quantité de sels minéraux, comme l'eau, est exprimée en mg/l.
Discours organiques. Parmi ceux-ci, les plus importants sont les mots du voyage de la créature, les fragments de puanteur peuvent contenir divers microbes pathogènes. Un indicateur hygiénique indirect de la présence ou de la présence de ces substances dans l'eau est l'oxydation de l'eau.
Oxydation de l'eau. La quantité d'acidité (mg) dépensée pour l'oxydation externe des substances organiques contenues dans 1 litre d'eau (indiquée en mg/l). Plus la quantité d'acidité dans l'eau est faible, plus la quantité d'acidité à la surface de l'oxydation dans 1 litre d'eau contenant des composés organiques est faible. Par exemple, l’oxydation des eaux souterraines pures ne dépasse pas 2 à 4 mg/l, celle de l’eau des rivières ne dépasse pas 7 mg/l.
L'un des indicateurs de la présence éventuelle d'acides organiques dans l'eau est la quantité d'acidité qui y est dissoute (mg). Dans les eaux propres, 3 à 6 mg/l d'eau acide ont été libérés, et dans les eaux polluées, beaucoup moins, jusqu'à disparaître complètement.
La présence d'ammoniac, de sels nitreux et d'acides nitriques peut être observée en présence d'ammoniac, de sels nitreux et d'acides nitriques. L'ammoniac est un produit étapes d'épi la pourriture des déchets organiques issus de la cuisson et les sels des acides nitrique et nitreux sont les produits finaux de la minéralisation des déchets organiques. Il est évident que l’eau est obstruée depuis longtemps.
La présence de sels d'acides chlorhydrique et acide dans l'eau est une indication d'une éventuelle contamination de l'eau par des excréments d'animaux et de personnes (contamination fécale). Considérons qu’1 litre d’eau naturelle pure contient un peu plus de 20 à 30 mg de chlorures.
Dureté de l'eau. Il est indiqué à la place des sels de calcium et de magnésium. Divisez l'eau en petits morceaux, un morceau à la fois. Vous pouvez voir la dureté naturelle de l'eau - la dureté des eaux grises, la dureté spécifique, qui change lors de l'ébullition ou du repos, et non débordante, qui ne diminue pas après l'ébullition de l'eau.
Les légumes et la viande sont mal bouillis dans l'eau dure, car les protéines qu'ils contiennent sont combinées avec le calcium et le magnésium en substances inorganiques qui ne sont pas absorbées dans les intestins humains.
Une telle eau ne convient pas aux procédures hygiéniques : elle contient une quantité excessive de sels qui déborde, et des résidus indésirables se déposent sur les cheveux et forment du mitta.
La dureté de l'eau potable peut dépasser 7 mg/l. Cette caractéristique peut être exprimée en degrés (1 mg/éq de dureté de l'eau est égal à 2,8°). Une eau dure est une eau à plus de 20°, une eau douce à moins de 10°.
Les sels sont versés. L'eau qui s'écoule n'est pas bon marché, mais en quantité surnuméraire, elle confère un goût métallique amer et un arôme jaunâtre ou brun jaunâtre, réduisant ainsi la clarté. L'eau potable peut contenir jusqu'à 0,5 mg/l (dans les masses d'eau froides) et 1,0 mg/l (dans les masses d'eau souterraines).
Fluor. Tout ce qui se trouve dans l’eau potable s’écoule de manière significative sur les dents. Lorsque la concentration augmente, une fluorose apparaît (apparition de taches sombres sur l'émail des dents), entraînant leur carie ultérieure, et si la carie dentaire est insuffisante, la maladie carieuse devient plus fréquente. L'eau ne contient pas plus de 1,5 mg/l de fluorure, l'acidité optimale est de 0,7 à 1,0 mg/l. Si le fluorure n’est pas éliminé, l’eau doit être fluorée individuellement et du fluorure de sodium ajouté.
Les plans d'eau naturels (terrestres) ont des processus naturels d'auto-purification, car les humains ne peuvent pas les surmonter :
*Exempt de rayonnement ultraviolet ;
*Sédimentation et séparation des particules importantes ;
*Oxydation des substances organiques due à la teneur en O2 ;
* Minéralisation des surplus organiques due à la croissance bactérienne.
Face 1
Le stockage de l'eau des rivières est déterminé par la quantité et la force des ruisseaux qui s'y déversent à partir du sol et du vent, ainsi que par les eaux usées des entreprises industrielles et municipales.
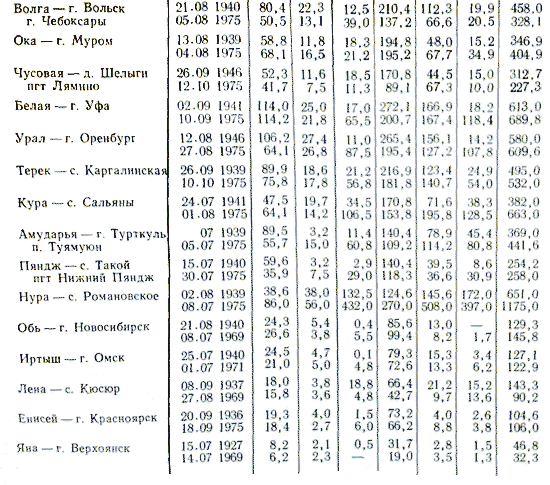
La classification du stockage des eaux fluviales est présentée dans la Fig. 3.24 est simplifié et ne s’avère pas toujours efficace.
Comme l'ont montré des recherches approfondies sur le stockage de l'eau de rivière, la régulation du débit d'eau du réservoir de stockage ne nécessite pas autant de changements importants que l'eau de rivière peut être apportée. en utilisant les méthodes actuelles analyse.
En raison des particularités saisonnières, les modifications du stockage de l'eau de la rivière doivent être rétablies au moment de la conception de l'installation. La classe cutanée des cations importants est divisée en trois groupes : le calcium, le magnésium et le sodium. À sa manière, le groupe cutané est divisé en quatre types d'eau, identifiés par un certain nombre d'ions. La crème contient des cations importants, l'eau de rivière contient des ions K, NH4, Fe2, Mn2, Cu2, Zn2, Ni2, Fe3, Al3 et, à des concentrations plus faibles, un certain nombre d'autres ions.
Comprendre la nature de l'évolution de la puissance et de l'écoulement des eaux fluviales le long des formations naphta, en 1957. Les foreurs de TatNIPInafta ont foré eux-mêmes cinq foreuses à injection.
Proche colonies Et les eaux usées industrielles peuvent fournir un afflux important d’eaux usées industrielles vers l’entrepôt d’eau fluviale.
Avec les conseils de la table. 3 figures montrent que le stockage de l’eau des rivières varie selon de larges frontières. Les eaux des rivières qui traversent des zones fertiles sont pleines de carbonates et riches en calcium. Les eaux des rivières qui traversent des zones sèches (par exemple dans l’ouest des États-Unis) contiennent plus de sulfates, moins de calcium et donc moins de carbonate. On aurait tort d’ignorer la quantité de fluide organique transportée par les eaux dont les fragments sont transformés en naphta.
Le stockage chimique des eaux souterraines au niveau des prises d'eau côtières est en d'autres termes le stockage de l'eau fluviale, qui, à sa manière, est désignée comme stockage de précipitations atmosphériques, mais aussi comme stockage de neige, de tempête et de ruissellement souterrain. Dans l'atmosphère, l'eau de pluie et la neige s'accumulent grande quantité l'acidité, le dioxyde de carbone, l'oxyde nitrique, les sels d'ammonium et dans l'environnement pollué des zones industrielles, comme on entend par substance, de la sciure de bois, des bactéries, du sirop, des produits de combustion du charbon, du naphta et d'autres substances y sont ajoutés.
En conséquence, seule une petite quantité d’eaux usées obstruées s’écoule à proximité de la rivière, ce qui entraîne un épuisement du stockage des eaux usées de la rivière, éliminant ainsi la possibilité d’une liquidation ultérieure.
La puanteur est concentrée sous forme de minéraux, par exemple le gypse Ca8O4 - 2H2O, la mirabilite Na28O4 - 10H2O, et entre également dans le stockage de l'eau de mer et de rivière.
Les eaux supérieures des rivières (ainsi que les lacs et les eaux) sont caractérisées par l'abondance de leur stockage, qui résulte de la vie des plantes et des créatures qui se trouvent à proximité de l'eau, et de l'événement principal des crues printanières et des planches qui emportent les eaux. abrite un nombre important de particules de sol. Dans le même temps, à proximité des zones peuplées, les rejets d'eaux usées et les déchets des entreprises industrielles se déversent souvent dans la zone de stockage des eaux fluviales.
L'entrepôt de produits chimiques dans la rivière reconnaît les fluctuations saisonnières. La plus grande minéralisation de l'eau fluviale se produit pendant la période où la rivière regorge d'eaux souterraines, et la moindre est due à la saison des pluies ou à la vie des calottes glaciaires. Le stockage des eaux fluviales est entre les mains des esprits physico-géographiques. Dans les zones aériennes, la minéralisation de l'eau est faible. La minéralisation change également à mesure que la rivière coule dans l'influent, la prise d'eau étant située dans d'autres bassins de moulage.
Le stockage de l’eau des rivières, ainsi que des déchets, est stocké jusqu’à la fin des temps. Le moins de boue et la plus grande minéralisation se produisent pendant l'hiver, mais l'inverse se produit lors des crues, surtout au printemps. Au moment du destin, les drains météorologiques, les vents d'été et d'autres facteurs se jettent dans le réservoir d'eau de la rivière.
L'entrepôt chimique des eaux naturelles est très pliable. Ils ont plus de famille éléments chimiques, qui sont calculés en parties de grammes ou en entiers et même en dizaines ou centaines de grammes par litre d'eau. Ce sont les éléments présents dans l’eau et l’apparition d’ions ou de molécules qui créent des structures complexes, notamment organiques.
Le stade et la nature de la minéralisation de l'eau dans cette localité et dans d'autres sont perturbés par l'eau. Au lieu de la décomposition des substances minérales et en partie organiques non volantes dans l'eau, la quantité d'excès sec (la quantité principale, la totalité des chlorures, sulfates, carbonates et bicarbonates, métaux des prairies et des terres des prairies) est caractérisée. Les eaux qui contiennent une grande quantité de sels minéraux peuvent donner un goût salé ou amer-salé désagréable, de sorte que la quantité d'eau potable sèche en excès est soumise aux pratiques sanitaires en raison de son influence sur le pouvoir savoureux de l'eau de la rivière. même 1000 mg /l. Des études expérimentales ont montré que l'optimum (propriétés organoleptiques) est une eau nutritive contenant 200 à 400 mg de sels par litre. L'eau avec un excès sec allant jusqu'à 1000 mg/l est dite fraîche, et au-dessus de 1000 mg/l - minéralisée.
Les changements dans le niveau primaire de minéralisation de l'eau, s'ils ne sont pas dus à des raisons naturelles (crues printanières), peuvent être considérés comme une indication d'une contamination de l'eau par des rivières tierces.
Les chlorures de l'eau se concentrent notamment sous forme de chlorure de sodium et, au moins, sous forme d'autres composés (chlorure de magnésium, etc.). Dans les eaux naturelles, les chlorures apparaissent suite à leur élimination des formations du sol. Les zones au sol salin sont particulièrement riches en chlorures. Les chlorures sont importants en tant que substances qui modifient le goût de l'eau et affectent les fonctions physiologiques du corps. À partir d'une concentration de 500 mg/l, les chlorures provoquent une suppression de la sécrétion des limaces, ce qui se traduit par une modification de l'acidité et de la force du jus de limace, qui empoisonne. En conséquence, l’évacuation de la vie du navire va s’accélérer. À une concentration supérieure à 1 000 mg/l, le chlorure entraîne une modification de la diurèse, ce qui peut être particulièrement nocif pour les personnes souffrant de maladies cardiaques et de problèmes de santé. À des concentrations supérieures à 350 mg/l de chlorure, ajouter de l'eau salée au mélange.
Les chlorures peuvent être perdus dans l'eau à partir des matières fécales, des déblais, des déchets de cuisine. Pour l'approvisionnement en eau municipale, l'eau qui n'est pas susceptible d'être contaminée, les chlorures peuvent être importants en tant qu'indicateur indirect de la contamination quotidienne de l'eau. Chez qui la concentration en chlorures n'est pas évaluée, quelle est alors la variation de l'heure et du plan d'eau. augmentation contre les concentrations naturelles d’urgence. La forte présence de chlorures et d'ammoniac dans les plantes à forte oxydation et aux indicateurs bactériologiques désagréables indique les problèmes sanitaires de cette eau.
Les sulfates en quantités supérieures à 500 mg/l, ajoutent une gorgée d'eau salée à l'eau, à une concentration de 1000-1500 mg/l et suppriment généralement la sécrétion du scutum, ont un effet laxatif sur les intestins et conduisent à un attitude négative envers les goûts des gens, arroser leurs yacks. Les sulfates peuvent être un indicateur de la contamination des eaux de surface par des excréments d'animaux, car la partie de stockage des corps protéiques est le soufre qui, une fois décomposé et oxydé davantage, est transformé en sel d'acide sulfurique.
La dureté de l'eau indique la concentration de cations métalliques divalents de l'herbe, en premier lieu le calcium et le magnésium. Les ions Ca(2+) et Мg(2+) peuvent être associés à différents anions (HCO 3 , SO 4 , Cl , CO 3 , HNO 3 etc.).
Les hydrocarbonates de calcium et de magnésium Ca(HCO 3) 2, Mg(HCO 3) 2 et les carbonates CaCO 3, MgCO 3 indiquent la dureté carbonatée. Lorsque l'eau est chauffée, le mélange de carbonates est détruit (passe à 2), ce qui entraîne la transformation des hydrocarbonates en carbonates.
La différence entre les carbonates de calcium et de magnésium est nettement inférieure à celle des carbonates, donc avec l'eau bouillante, la dureté diminue. La dureté de l'eau, composée d'hydrocarbures de calcium et de magnésium, est appelée carbonate. La dureté carbonatée est souvent combinée à la dureté conventionnelle, mais il est impossible de les assimiler une à une. Avec une concentration élevée d'hydrocarbonate de magnésium dans l'eau, la différence entre le carbonate et la dureté conventionnelle peut être importante. La valeur de la dureté relative évite pratiquement la teneur en humidité de l'eau, qui contient à la place des hydrocarbonates du sol des métaux (Ca, Na, Mg, K) et d'autres sels d'acides faibles. La teneur en humidité de l'eau est importante pour le processus de coagulation de l'eau lors de la purification. La différence entre la cruauté légale et conventionnelle s'appelle cruauté constante, il est associé à une grande quantité de calcium et de magnésium, associés à d'autres anions en plus des hydrocarbonates (Cl, SO 4, NO 3...).
La dureté de l'eau est l'un des critères essentiels de la dureté de l'eau potable. L'eau dure ne convient pas aux besoins gouvernementaux : les légumes, la viande et la volaille sont bouillis dans de l'eau dure. aspect extérieur, le goût et la douceur du thé, il est mauvais de le boire sucré, car le sodium qu'il contient est remplacé par le calcium et le magnésium dans l'eau, ce qui entraîne la création d'un sédiment de calcium et de magnésium. L’eau dure peut provoquer des maladies et une peau sèche ; Dans les appareils de chauffage des systèmes d'alimentation en eau chaude, l'eau dure crée un léger sédiment, ce qui complique leur fonctionnement.
En ce qui concerne la santé, une amertume élevée peut être considérée comme l'un des facteurs contribuant au développement de la lithiase urinaire, comme cela a été dit ci-dessus. Au cours des trois prochaines heures, la nutrition sera abordée afin d'insuffler de la gourmandise au système cardiovasculaire ; Il existe des données sur le taux de mortalité dû aux maladies cardiaques dues à la consommation d'eau potable douce. Cette hypothèse n'a pas été confirmée dans de nombreux pays.
Il pénètre dans une partie invisible de l'organisme créé et est utilisé pour stimuler les enzymes dicholiques (hémoglobine, catalase, etc.). On peut le voir quitter le corps par les intestins. Le corps satisfait ses besoins dans la pièce principalement en vivant avec son environnement, c'est-à-dire la taille avec laquelle il peut entrer dans le corps. boire de l'eau, n’a pas de réelle signification physiologique. La libération de Fe(2+), Fe(3+) se produit dans toutes les eaux naturelles à des concentrations variables. À des concentrations élevées dans les plans d’eau, il en résulte une collecte d’eaux usées. Lorsque l’eau est distribuée à travers des tuyaux en acier (non galvanisés), au lieu d’y pénétrer, la corrosion augmente en conséquence. L'effet toxique de l'ingestion sur l'organisme est inconnu. Lorsqu'elles sont administrées par voie orale, des doses plus élevées (300 mg/kg ou plus) ont été utilisées pour prévenir la gastro-entérite sans signes d'intoxication. Par conséquent, la présence d'eau à proximité de l'eau n'est pas due à une irritation esthétique et quotidienne, elle donne donc à l'eau un goût kalamutnost, une préparation et une saveur métallique amère. De plus, l'augmentation des concentrations de salinité dans l'eau favorise le développement de bactéries salivaires : lorsque les conduites d'eau s'éteignent, de lourds sédiments s'accumulent, ce qui modifie leur diamètre. Il a été établi qu'une augmentation de la clarté et de la couleur de l'eau se produit lors de l'infusion de liquides acides et oxydés, et dans tous les cas, la puanteur est due à la présence d'hydroxyde dans le liquide. Lorsque la concentration de l'eau est modifiée à 0,3 mg/l, la clarté et la couleur de l'eau sont égales à la norme. Le goût métallique de l'eau apparaît à la concentration de 0,5 mg/l. Sur la base de la méthode d’expérimentation auprès de la population, il est clair qu’avec une capacité de perfusion nettement plus grande (supérieure à 1,0 mg/l), l’eau peut provoquer divers effets sur la peau d’une personne, notamment des démangeaisons et une sécheresse.
Pour amener la couleur de l'eau à la norme requise, des méthodes spéciales de coloration de la couleur de l'eau sont utilisées dans les usines de traitement de l'eau. Pour remplacer les sulfates, chlorures et autres sels dans l’eau, l’eau est dessalée en ajoutant différents sels. Le dessalement est effectué à l'aide des méthodes de distillation, d'échange d'ions et d'électrodialyse. Dans l'esprit de l'approvisionnement local en eau, la méthode de congélation au froid naturel et à la congélation par morceaux est utilisée.
Pour la désinfection de l'eau, on utilise les méthodes suivantes : aération (oxydation) et trempage avec de l'hydroxyde extrait davantage du liquide, qui a été éliminé par repos et filtration ; ainsi que coagulation vicoriste de l'eau et cationisation.
Pour adoucir l'eau (élimination permanente ou partielle des cations de l'eau Ca(2+) et Mg(2+), des méthodes réactives sont utilisées, basées sur le traitement de l'eau avec des réactifs qui se combinent avec les ions calcium et magnésium, des substances pratiquement indispensables qui sont assiégées. (C'est pourquoi il est nécessaire d'ajouter de la vapeur éteinte lorsqu'elle est combinée avec de la soude). Plus pratique Ayant également adopté la méthode d'échange d'ions pour adoucir l'eau des résines échangeuses d'ions. L'adoucissement de l'eau par la méthode d'échange d'ions peut être réalisé à l'aide de bains de cations N, de bains de cations H, de bains de cations N-Na parallèles ou ultérieurs.
Dans l'analyse sanitaire et chimique de l'eau, un rôle important est joué par la concentration de sels d'ammoniac, d'acides azotés et nitriques (nitrites et nitrates), qui est un indicateur indirect de la contamination de l'eau par des déchets organiques.
Les substances organiques créées naturellement que l'on trouve dans l'eau sont sujettes à la dégradation et la minéralisation se produit en raison de la présence de micro-organismes qui habitent l'eau. Ce processus se déroule plus intensément par temps chaud et en raison de la présence d'acide dans l'eau. La minéralisation des substances organiques azotées se déroule en deux phases. Dans la première phase, appelée amonification, les protéines et les substances se désintègrent en acides aminés et en sels. La dégradation des protéines se produit sous l'afflux d'anaérobies (B.putrificus, B.sporogenes et autres), d'anaérobies facultatifs (B.micoides et autres) et d'aérobies (B.mesentericus, B.subtilis et autres). L'amonification de la graine est provoquée par des urobactéries et des microbes. Les restes d'ammoniac sont un produit en torchis, dont la présence parle d'eau fraîche fermentée biologique.
Dans une autre phase de minéralisation - la nitrification - l'ammoniac et les sels sont oxydés en nitrites (avec l'aide de B.nitrosomonas) et les odeurs sont oxydées en nitrates (avec l'aide de B.nitrobakter). Pour reconstituer des sels d'ammonium avec du nitrite, il est nécessaire de confirmer que l'eau a été récemment contaminée par des substances organiques. Les nitrates sont le produit final de la minéralisation des composés organiques et leur présence est un indicateur d'impureté à long terme dans l'eau.
Les composés azotés nous permettent d'établir la présence d'une contamination de l'eau, et il y aura des informations sur l'âge de la contamination. Ainsi, si la présence d'ammoniac dans l'eau lors d'analyses répétées n'augmente plus, il est possible de conclure que l'eau a été contaminée et ne l'est plus. En même temps que l'ammoniac, des nitrites apparaissent dans l'eau, ce qui indique qu'il y a une eau systématiquement polluée ces derniers temps. Et s'il y a de l'ammoniac, des nitrites et des nitrates dans l'eau, cela indique un réservoir d'eau extrêmement défavorable, c'est-à-dire un réservoir d'eau de longue date et régulièrement pollué.
Si l'eau présente chaque jour des nitrates, de l'ammoniac et des nitrates, cela indique que les processus de minéralisation des substances organiques sont terminés et que, par conséquent, les impuretés ont été éliminées.
Il convient toutefois de noter que la contamination de l’eau par des flux de déchets organiques n’est pas la seule raison de l’apparition de flux azotés dans l’eau. Dans les eaux propres et profondes, une acidité peut se produire chaque jour, ce qui entraîne la création de lavages pour renouveler les déchets minéraux de nitrites et d'ammoniac. Ce type d'augmentation de la concentration de sel d'ammoniac et de nitrites dans les eaux interstratales profondes n'indique pas une obstruction. D’autres signes d’eau obstruée apparaîtront tout au long de la journée.
Les sels d'ammonium, les nitrites et les nitrates présents dans l'eau trempée dans l'eau peuvent être des produits de décomposition et sont des produits de décomposition de substances organiques issues de dépôts aqueux. Les substances azotées peuvent être perdues dans l'approvisionnement en eau via les eaux usées industrielles, ainsi que dans les eaux usées provenant de zones clairement fertilisées avec des substances azotées.
Ainsi, pour une évaluation hygiénique correcte de la présence de composés azotés dans l'eau, il est nécessaire d'établir la raison de leur apparition dans l'eau. A propos de l'impureté de la matière organique dans l'eau, on peut parler plus favorablement du fait que, parallèlement aux composés minéraux azotés de l'eau, d'autres indicateurs d'impureté apparaissent : chimiques (forte oxydation) et microbiologiques (faible quantité, quantité élevée). U eau du robinet, qui peuvent être non contaminés, les sels d'ammonium et les nitrites en tant qu'indicateurs indirects de problèmes épidémiologiques dans l'eau perdent de leur importance. Prote, dans l'eau du robinet non contaminée par le chlore, au lieu des sels d'ammonium, la concentration ne doit pas dépasser 0,5 mg/l, car grâce à l'ajout de moins de substances actives - chloramines, le vitrate de chlore pour l'infection augmente de 2 à 4 fois.
Dans les réserves d'eau locales, en raison des normes d'hygiène établies, l'azote salé d'ammonium est autorisé jusqu'à 0,1 mg/l, l'azote nitrite jusqu'à 0,002 mg/l. En raison de l’activité minérale ou algale, ils constituent des indicateurs importants d’obstruction et peuvent être utilisés à la place de l’eau.
La perte de nitrates, qui provoquent une méthémoglobinémie à des concentrations élevées de puanteur, est d'un intérêt indépendant. Selon la théorie actuelle du nitrate dans les intestins, les gens continuent à nitrater sous l'afflux de bactéries qui hésitent dans le nouveau. L'humidification des nitrites est réalisée jusqu'à ce que la méthémoglobine soit stabilisée. Ainsi, la maladie repose sur le même stade de famine aigre, dont les symptômes se manifestent d'abord chez les enfants, notamment au niveau de la poitrine, ce qui est important dans le cas d'une préparation individuelle (diluer les mélanges de lait en poudre avec de l'eau pour mélanger les dépenses) ou une fois consommée, le prix de l'eau pour pitya. Les enfants plus âgés et les adultes sont moins sensibles à la maladie, car ils expriment plus fortement leurs mécanismes compensatoires. La concentration de nitrates est égale à 45 mg/l (une fois convertis en NO 3) et est acceptée en toute sécurité comme GDC dans l'eau potable. Des concentrations élevées de nitrates se trouvent principalement dans les eaux souterraines, résultat d'une obstruction persistante des eaux (en particulier des eaux souterraines) et de modifications minérales liées aux caractéristiques géochimiques des roches aquifères. Dans l'eau imbibée d'eau, la concentration de nitrates n'est généralement pas élevée et la puanteur restante est associée aux peluches aquatiques. Le coupable pourrait être l’apparition d’une contamination massive de l’eau et des eaux usées, qui empêcherait les nitrates.
Les nitrites, étant des composés instables, ne s'accumulent pas dans l'eau à des concentrations toxiques, ils n'ont donc aucune signification en tant qu'hydroxyde contenant de la méthémoglobine.
L’une des causes les plus importantes des caries dentaires est le manque de fluorure dans l’eau potable et, par conséquent, le manque de fluorure dans l’organisme. Attention à la présence directe de fluorure dans l'eau potable et aux risques de caries dentaires. Le fluorure, associé au calcium et au phosphore, assurera la dureté et la douceur des brosses et des dents.
Le fluorure a un effet hématogène après trempage tractus scilico-intestinal. D'une part, le fluor stimule le processus de minéralisation de la dent, d'autre part, entraînant une fluoroapatite, il modifie la structure des tissus durs de la dent, augmentant ainsi leur résistance aux facteurs cariésogènes chimiques et biologiques, qui agissent à la bouche vide.
Dans les eaux de surface, la concentration en ions fluor est importante jusqu'à 0,5 mg/l, et l'eau de ces eaux est vikoriste pour la plupart des moyennes et grandes localités. La concentration optimale de fluorure dans l'eau potable est de 0,7 à 1,2 mg/l. De faibles concentrations de fluorure augmentent la gravité des caries. Un excès de fluor (supérieur à 1,5 mg/l) conduit à la fluorose, qui affecte la santé reproductive, notamment celle du coton. La fréquence des maladies respiratoires et des concentrations élevées de fluorure est fiable.
Lorsque la teneur en fluorure est inférieure à 0,5 mg/l, il est recommandé de fluorer l'eau du robinet, ce qui réduit l'incidence des caries dentaires de 65 à 70 %. Il convient de rappeler que l'absorption du fluorure de l'eau est 20 % plus rapide que celle des produits, ce qui garantit une installation minutieuse avant la fluoration de l'eau. Avec la fluoration actuelle de l'eau, sa teneur en fluorure se situe entre 70 et 80 % du niveau maximum autorisé par la région climatique de la peau. Lorsque le fluor est présent au-dessus du niveau de la mer, une défluoration peut se produire dans l'eau.
Le mélange d'éléments chimiques et de sels typiques du stockage naturel de l'eau dans l'eau potable peut contenir des produits chimiques et des substances présents qui sont perdus dans les eaux industrielles et agricoles, ainsi que l'excès de liquide et les flux qui sont ajoutés à l'eau dans l'heure suivant l'échantillonnage. dans les stations d'épuration des eaux. Pour eux, le GDK a été créé, comme présenté dans SanPiNs. L’un de ces éléments est l’excès de chlore actif, qui est ajouté à l’eau non contaminée. Pour obtenir l'effet de non-contamination, des préparations contenant du chlore sont ajoutées en petites quantités, de sorte qu'après 30 minutes de contact avec l'eau et le chlore (suffisant pour réduire les formes végétatives de micro-organismes), il reste un certain excès dans l'eau ( excès dans l'eau).entre 0,3 et 0,5 mg/l. De grandes quantités ajouteront une odeur désagréable à l'eau, notamment en raison de la présence de phénols dans l'eau et de la présence de glucides halogénés, qui peuvent être cancérigènes.
| Statistiques sur le sujet : | |
|
Nous sélectionnons des volets roulants pour les fenêtres des balcons et loggias
Les stores sur le balcon sont la solution optimale pour un espace de vie calme et quotidien... Couleur corail non turbo à l'intérieur Intégration du bleu et du corail à l'intérieur
Et une de ces couleurs, à partir de laquelle vous pouvez réaliser de superbes... Plantation et entretien du rhododendron Plantation et entretien du rhododendron canadien
Dans la littérature étrangère, les rhododendrons sont amenés à un groupe de plantes pour y pousser. | |